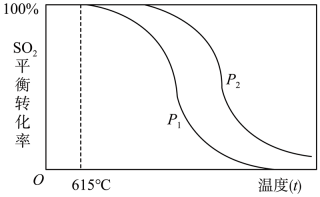
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。
 。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。
。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。
a.Fe b.FeO c.Fe2O3 d.Fe3O4
Fe2++H++NO=Fe3++NO↑+H2O
①配平上述反应。
②每生成0.5molNO气体,转移的电子数为。
③要检验该反应后的溶液中是否还含有Fe2+ , 实验方案是。
现在可以利用铁氧化物循环裂解水制备氢气,其过程如图所示:


已知:①Fe3O4+CO⇌3FeO+CO2-Q1(Q1>0)
②Fe3O4+4CO⇌3Fe+4CO2+Q2(Q2>0)
推测当温度达到570℃,平衡时CO体积百分含量最高的原因:。

检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
a.水 b.酒精 c.油 d.乙酸
该样品中AlCl3的质量分数为(保留3位有效数字)。
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质

完成下列填空:
i.属于芳香族化合物,能发生银镜反应
ⅱ.只含有2种化学环境不同的氢原子
 的路线。(无机试剂与溶剂任选,合成路线常用的表示方式为:A
的路线。(无机试剂与溶剂任选,合成路线常用的表示方式为:A