
常温下,各种离子沉淀时的pH如下表:
离子 | |||
开始沉淀时的pH | 1.5 | 3.4 | 8.2 |
完全沉淀时的pH | 2.8 | 4.7 | 10.2 |
Ⅰ.
Ⅱ.
请回答下列问题:

①该反应的催化剂是,该物质还有另一个作用一提高DMC的平衡产率,结合反应机理图分析其中的原因:。
②将物质的量之比为1∶2的和
的混合气体以相同流速通过两种不同的催化剂a、b,仅发生反应Ⅱ.相同时间内
的转化率如图2所示。

M点(填“是”或“不是”)对应温度下的的平衡转化率,原因是。
①对于反应Ⅱ,活化能(填“>”或“<”)
。
②时,该温度下
。某温度下,在5L恒容密闭容器中充入5mol
和10mol
, 发生反应Ⅰ、Ⅱ,反应经10min达到平衡,此时
,
, 则
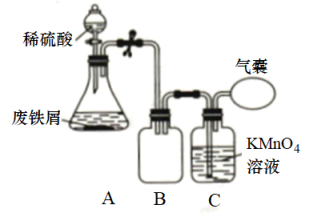
Ⅰ.碱煮水洗:将6.0g废铁屑置于锥形瓶中,加入20mL30%的溶液,加热煮沸一段时间,倾去
溶液,水洗至中性;
Ⅱ.的制备:向处理过的铁屑中加入稀
反应,结束后趁热过滤;
Ⅲ.硫酸亚铁铵晶体的制备:向滤液中迅速加入一定体积的饱和溶液,经蒸发皿加热至出现晶膜时停止加热,冷却结晶硫酸亚铁铵晶体,再过滤、洗涤、干燥得到产品。
回答下列问题:
准确称量20.00g硫酸亚铁铵晶体样品,配制成100mL溶液。取所配溶液25.00mL于锥形瓶中,加稀酸化,用0.1000
标准溶液滴定至终点,重复两次,平均消耗
标准溶液18.00mL。
①判断达到滴定终点的标志是。
②样品中的质量分数为。
已知的
。
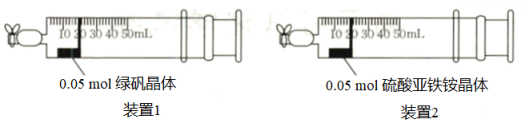
向两支注射器中分别放入0.05mol的绿矾晶体和硫酸亚铁铵晶体,向右侧拉动注射器活塞,各吸入20mL空气后关闭注射器针头处的夹子(密封性良好),放置一段时间后,取出两种晶体,用无氧蒸馏水溶解配成等体积的溶液,向溶液中各滴加几滴KSCN溶液。
①获得无氧蒸馏水的方法为。
②若硫酸亚铁铵晶体的抗氧化能力强,则放置一段时间后,活塞向左移动的距离较长的是(填“装置1”或“装置2”)。