净化铁屑:为去除废铁屑表面的油污,可采用的方法为。

“酸溶”过程中,为加快反应速率,可向其中加入少量固体单质X,则X可以为(填化学式,写出一种即可);“过滤”过程如图2所示,为防止大量铁屑进入漏斗引起堵塞,可将紧贴在烧杯外壁a处,再倾倒烧杯中的混合物。
称取4.000 g上述产品,配成100 mL溶液,取出25.00 mL置于锥形瓶中,用 , 标准溶液滴定,重复三次,消耗
标准溶液的平均体积为10.00 mL。
①将标准溶液装入滴定管后,排气泡的正确操作为(填选项字母)。
a. b.
b.  c.
c. d.
d.![]()
②经计算,该产品的纯度为%。
莫尔盐自身受热分解会产生、
、
、
等气体,小组同学欲用下图装置检验其中的
和
。

装置连接的合理顺序为(填装置编号),装置C中盛装碱石灰的仪器名称为。


反应Ⅰ:
反应Ⅱ:
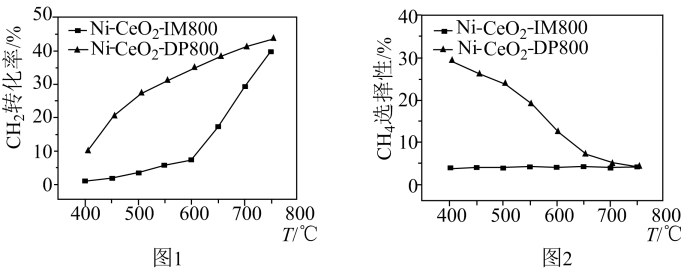
①图1中,选用Ni-CeO2-IM800催化剂时,CO2(g)的转化率在温度高于600℃后迅速增大,解释其原因为。
②600℃时,为提高CO(g)的产率,适宜选择的催化剂为(填“Ni-CeO2-IM800”或“Ni-CeO2-DP800”),解释其原因为。

①图中表征压强为0.1 MPa的是(填“L1”“L2”或“L3”)。温度升高,三条曲线逐渐靠近的主要原因为。
②Q点时,测得CH4(g)的物质的量为b mol。则该温度下,反应Ⅰ的平衡常数K=(用含a、b的代数式表示)。