
ZnO是锌的一种氧化物,不溶于水、乙醇,可溶于大多数酸、强碱等,在浓氢氧化钠溶液中可生成。
ZnO有着广泛的用途。它可用作白色颜料,俗称锌白,其优点是遇酸性气体不变黑,因为生成的ZnS也是白色的。ZnO也可用于某些化工原料气的脱硫,利用ZnO水悬浊液吸收
, 再通入空气,最终可得到
。ZnO具有收敛作用,可杀菌并且加速伤口愈合,在医药上常调制成软膏。ZnO还是新一代的光电半导体材料,因其具有良好的抗辐射性能,可以在太空等环境应用。
工业上有多种制备ZnO的方法,直接沉淀法是其中一种。该法是以可溶性锌盐和一水合氨()为原料,发生如下反应:
;
。用此法可以制得纳米级ZnO,其在磁、光、电、敏感性等方面具有普通ZnO无法比拟的特殊性能和新用途。
a.酸性氧化物 b.碱性氧化物 c.两性氧化物
①ZnO用于工业脱硫的反应方程式为。
②ZnO可用作光电半导体材料。
③用一水合氨制备ZnO的反应不是氧化还原反应。
④纳米级ZnO和普通ZnO粒子大小不同,性能有所不同。
a.只含有离子键 b.只含有共价键 c.既含有离子键又含有共价键
①K在元素周期表中的位置是。
②属于第二周期且非金属性由弱到强的顺序为。从原子结构角度解释原因:在同一周期中,,得电子能力逐渐增强,非金属性逐渐增强。
a.常温下化学性质稳定 b.
的沸点低于红磷的沸点
c.受热分解的温度高于
d.
的酸性强于
资料:i.胶体可以透过滤纸。 ii.与
溶液反应,生成蓝色沉淀。
①取少量A,过滤得到红褐色沉淀和黄色透明液体B。
②取少量B于试管中,加入溶液,(填现象)。
③取少量B于试管中,加入(填试剂),液体变为红色。
④用激光笔照射B,看到一条光亮的“通路”。
综合上述实验,说明A中铁元素的存在形态有、
、和。
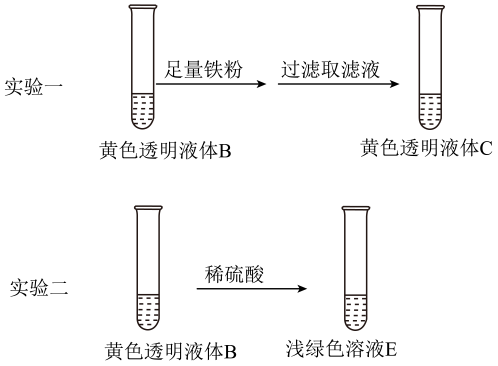
①实验一中,加入铁粉的作用是(用离子方程式表示)。
②由上述实验得出:B显黄色的主要原因不是因为含有 , 而是因为含有。理由是: 。
①取25.00mL A,加入足量稀硫酸,可与24.00mL溶液恰好完全反应。已知
在酸性环境下被还原为
, A中
的浓度为
, 说明其主要成分仍然是
。
②下列实验可以使用A进行的是(填字母)。
a.向A中滴入NaOH溶液,制备纯净的沉淀
b.用A处理含有+6价Cr的酸性废水,将剧毒的+6价Cr还原至低毒的+3价
经过上述探究,实验小组对溶液的配制与使用有了更深入的理解。

已知:是难溶于水的酸性氧化物。

①补全反应的化学方程式:
②上述制备过程中,不能快速滴加溶液的原因是。
取a g样品加水稀释,在不断搅拌下加入溶液调至
, 此时铁元素全部转化为
沉淀,过滤、洗涤并灼烧所得沉淀,最终得到b g红棕色固体。则产品中铁元素的质量分数为。