反应①:
反应②:



回答下列问题:

由图可知双氧水的合适用量mL,增加双氧水的投加量,砷浸出率先增加的原因。


初步设计的实验装置示意图如图1所示,溶液在图1所示装置中的作用是(答两点)。
实验发现:该装置不能驱动小车。
该小组同学提出假设:
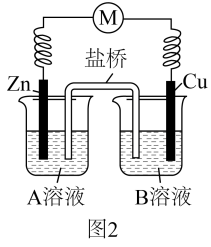
可能是氧化反应和还原反应没有完全隔开,降低了能量利用率,为进一步提高能量利用率,该小组同学在原有反应的基础上将氧化反应与还原反应隔开进行,优化的实验装置示意图如图2所示,图2中A溶液和B溶液分别是和,盐桥中的移向溶液。

仪器a的名称为,实验中还需要用到的玻璃仪器是。
装置 | 步骤 | 电压表读数 |
| ⅰ.如图连接装置并加入试剂,闭合K | a |
ⅱ.向B中滴入 | b | |
ⅲ.再向B中投入一定量 | c | |
ⅳ.重复ⅰ,再向B中加入与ⅲ等量 | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
步骤ⅰ中,B中石墨上的电极反应式是。