序号 | 装置 | X溶液 | 现象 |
Ⅰ |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
Ⅱ | Na2SO4溶液 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
Ⅲ | H2SO4溶液 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |

B装置可除去A装置中可能挥发出的。D装置可除去C装置中未反应的。
为了验证氯气的部分性质,某小组同学设计如图实验装置制取纯净、干燥的氯气后验证其性质,并进行尾气处理。
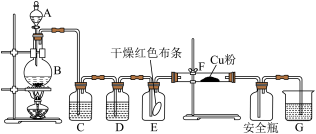
①装置C、G中盛装的试剂分别为、。
②该实验可得出氯气具有的化学性质是,。(写2条)
③上图制备氯气的化学反应方程式为。

①反应I的化学方程式为。
②该方法制取氯气,主要消耗的原料是。
a.用量筒量取____mL浓H2SO4缓缓注入装有约50 mL蒸馏水的烧杯中,并用玻璃棒不断搅拌。
b.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都转入容量瓶中。
c.待稀释后的H2SO4冷却至室温后小心转移入容量瓶中。
d.检查容量瓶瓶口部是否会发生滴漏。
e.将蒸馏水直接转入容量瓶,至液面接近刻度线1~2 cm处。
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
g.用____向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和刻度线相切。
a.150 mL b.100 mL c.250 mL
①用量筒量取浓硫酸时,仰视刻度线
②用胶头滴管定容时,俯视刻度线
③配制前,容量瓶瓶壁上有少量水
④未进行上述b操作