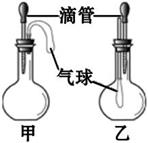
| 甲 | 乙 | |
| A. | 稀硫酸和铜片 | 水和硝酸铵固体 |
| B. | 水和氢氧化钠固体 | AgNO3溶液和稀盐酸 |
| C. | 双氧水和MnO2 | NaOH溶液和CO2 |
| D. | Na2CO3溶液和稀硫酸 | 水和浓硫酸 |
| 选项 | 实验目的 | 实验方案 |
| A | 除去稀硫酸中的FeSO4 | 加入适量锌粉 |
| B | 除去CO2中的CO | 将气体通入NaOH溶液 |
| C | 除去CaCl2溶液中的HCl | 加过量CaCO3 , 过滤 |
| D | 除去铝粉中的铜粉 | 加适量稀硫酸,过滤 |




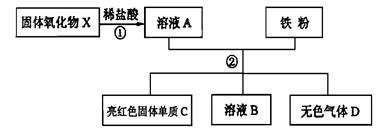
|
实验 |
A+B |
A+C |
A+D |
B+C |
|
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
NaCl+H2O+nh3+CO2=NaHCO3↓+X;2NaHCO3Na2CO3+H2O+CO2↑等。则
①X的化学式为
②将碳酸钠和碳酸氢钠的混合物10g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为(写最简比)。

[提出问题 1] 该氢氧化钠溶液是否变质了呢?
[实验探究 1]
|
实验操作 |
实验现象 |
实验结论 |
|
取少量该溶液于试管中,向溶液中滴加足量的稀盐酸,并不断振荡 |
|
氢氧化钠溶液一定变质了。 |
[提出问题 2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想 1:氢氧化钠溶液部分变质。猜想 2:氢氧化钠溶液全部变质。
[实验探究 2]
|
实验步骤 |
实验现象 |
实验结论 |
|
⑴取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 |
有白色沉淀生成。 |
说明原溶液中一定有碳酸钠。 |
|
⑵取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有。 |
[实验结论]该氢氧化钠溶液部分变质。猜想 2 正确。
[思考与讨论]有同学认为,探究 1 已经证明了碳酸钠的存在,所以实验探究 2 中的实验步骤(1)是多余,只要如实验步骤(2),样品溶于水后,直接滴入酚酞即可的。该同学的看法是否正确?为什么?。

查阅资料:I.H2S能与NaOH等碱溶液、CuSO4溶液反应。
Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收。
①SiO2+2C Si+2CO↑ ②Si+2Cl2
SiCl4 ③SiCl4+2H2
Si+4HCl

①取质量、大小相同的 3 个烧杯,分别加入一定质量分数的稀盐酸 100 克;
②向上述 3 个烧杯中分别加入 3 份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
|
实验一 |
实验二 |
实验三 |
|
|
反应前稀盐酸+烧杯质量(克) |
150 |
150 |
150 |
|
反应前固体样品质量(克) |
4 |
8 |
12 |
|
反应后烧杯内物质+烧杯质量(克) |
m |
155.8 |
158.7 |

| 【小资料】铁和铜都能与FeCl3溶液发生反应,反应的先后顺序取决于金属的活动性顺序,金属的活动性越强,反应越优先,反应的化学方程式分别为: ①Fe+2FeCl3=3FeCl2; ②Cu+2FeCl3=2FeCl2+CuCl2 |