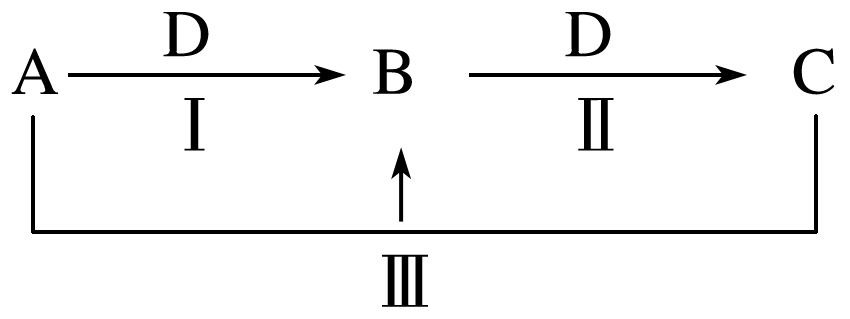
①B的化学式:。
②反应Ⅲ的离子方程式是。
①D的化学式是。
②写出B与石英砂高温的反应方程式。
①反应Ⅱ的离子方程式是。
②取少许C溶液于试管中,滴入NaOH溶液并振荡,产生沉淀,且沉淀一段时间后变色,写出相应的化学方程式:。
已知:①
②为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③的盐酸溶液可吸收CO而生成黑色颗粒Pd

回答下列问题:
① ②
③
④浓
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
①氯气 ②氧气 ③水蒸气 ④氩气

已知:①常温下:、
②为白色沉淀,微溶于水,易溶于强碱溶液
回答下列问题:
A.NaOH B.氨水 C.澄清石灰水
滤液Ⅰ可以继续返回“盐析”中,目的是。

①转化为
的离子方程式为。
②1mol至多可处理
的物质的量为。
①NaClO氧化的离子方程式为。
②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当时,总氮的去除率随
的增大不升反降的可能原因是。


①活性炭-臭氧氧化氨氮的机理可描述为。
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如图所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是。