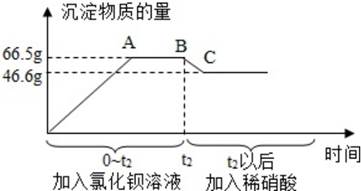
第一步:取50g该样品溶于水得到无色溶液;
第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸。产生沉淀的物质的质量与时间的关系如图所示,下列说法正确的是( )



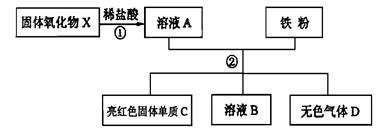
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定有Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能有四种物质;
③若步骤Ⅱ中有气泡产生,则固体乙一定是C;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无CuO;
⑤若固体乙呈红色,则原固体中一定含有Fe和CuO。
以上说法中正确的个数是( )

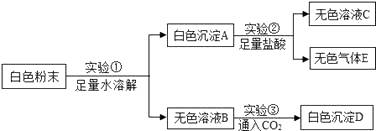
实验操作 | 实验现象 |
取该固体于试管中,加水、振荡 | 固体不溶解 |
取该固体于试管中,加盐酸、振荡 | 固体溶解,无气泡产生 |
一氧化碳通过炽热的该固体, 称固体质量、检测尾气 | 固体质量减轻,尾气中只检测到 CO 与 CO2 |

根据上述实验可推断:原白色粉末的组成有 种可能。
为进一步探究原白色粉末的组成,取实验(1)得到的滤液,向其中通入CO2 , 产生白色沉淀,则可推断原白色粉末中一定还含有

绿矾又名七水硫酸亚铁(FeSO4•7H2O),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等.绿矾(FeSO4•7H2O)的一种综合利用工艺如下:
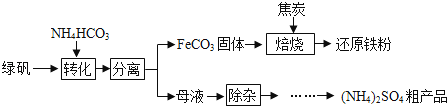
(1)细铁丝在氧气中可以燃烧,请写出铁在氧气中燃烧的化学方程式 .
(2)绿矾与NH4HCO3在溶液中反应,有CO2生成,反应的化学方程式为 .
(3)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3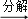 FeO
FeO Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式:
Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式:
A.FeCO3 FeO+CO2↑;
FeO+CO2↑;
B. ;
C. .
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为蒸发浓缩、、过滤、洗涤、干燥.
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】取一支试管,加入少量 AgNO3 溶液,再加入过量 NaCl 溶液,有白色沉淀生成。再往该试管中加入少量 KI 溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
或“小于”)。
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应。
实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫各小组开展探究.

【提出问题】这瓶无色溶液究竟是什么物质的溶液?
【猜想与假设】经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里.由此猜测:可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液.
【理论分析】为了确定该溶液,他们首先进行了分析:
设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验.
实 验 操 作 | 实 验 现 象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液. ②静置后,倾去上层清液,向沉淀中滴加稀盐酸. | 产生白色沉淀. 产生大量气泡,沉淀消失. |
【实验结论】
【实验反思】
实 验 操 作 | 实 验 现 象 |
|
|
假设一:红色固体只有Cu
假设二:红色固体只有Cu2O
假设三:红色固体中有Cu和Cu2O
请回答有关问题:
由实验②推断:不可能存在,原因是;
由实验③推断:不可能存在,原因是 。
实验室常用亚硫酸钠(Na2SO3)固体与稀硫酸在常温下反应制取二氧化硫气体.我们知道二氧化碳能与水反应生成碳酸,那么二氧化硫与水反应是否也能生成酸呢?某实验小组对此进行探究.
作出猜想】.
【查阅资料】①二氧化硫不与浓硫酸反应;②酸能使湿润的蓝色石蕊试纸变红;
③二氧化硫有毒,能与碱溶液反应生成盐和水.
【设计实验】一、验证水能否使蓝色石蕊试纸变色;
二、验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色;
三、验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红.
实验装置和药品如图:

【实验结论】根据以上实验操作和现象,原猜想(填“成立”或“不成立”).
【反思与拓展】是不是所有的非金属氧化物都能与H2O反应,生成相应的酸?(填“是”或“不是”).
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气,二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下发生反应生成氯化亚铁.Fe+2FeCl3═3FeCl2
②碱性的Na2CO3溶液可以和中性的CaCl2溶液发生复分解反应.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
实验操作 | 实验现象 | 实验结论 |
①取少量固体放于试管中,滴加一定量的 , 用带导管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中. | 试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清的石灰水变浑浊. | 样品中一定含有 ,不含Fe2O3 |
②取少量样品放入试管中,加水溶解,静置后取上层清液滴加无色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色 | 样品中含有 |
【实验质疑】
小组同学通过讨论认为实验中并不能得出一定含Fe2O3的结论,理由是 (用化学方程式表示).
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量试验.
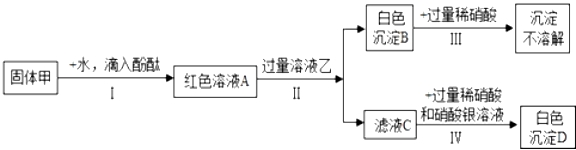
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照如图流程进行实验,请回答相关问题:

(1)操作二、操作三名称是;
(2)固体Ⅰ的成分是 (填物质化学式,下同);
(3)烧杯A中溶液和加入的碳酸钠溶液反应化学方程式为 ;
(4)依据实验探究1,2中现象的分析及数据计算判断,这包久置“双吸剂”固体的成分是 .
【实验反思】
下列对实验探究1、2的反思,不正确的是 (填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2烧杯C中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量盐酸有4个反应发生.
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】去一定量上述固体粉末,加足量水溶解。
【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:

①计算产生最大沉淀量时所加NaOH溶液的质量。
②通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)