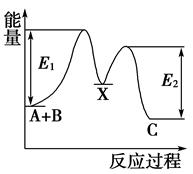
①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法错误的是( )

用0.1mol 配成稀溶液与足量稀硝酸反应,能放出kJ的能量。

的平衡转化率
%,反应平衡常数K=。
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
①写出化学平衡常数K的表达式。
②试比较K1、K2的大小,K1K2(填“>”、“<”或“=”);
③400℃时,反应2NH3(g)N2(g)+3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正v(N2)逆(填“>”、“<”或“=”)。