A | B | C | D |
|
|
|
|
研究压强对反应的影响(p2>p1) | 研究温度对反应的影响 | 研究平衡体系增加N2对反应的影响 | 研究催化剂对反应的影响 |

①图2中反应是(填“放热”或“吸热”)反应,该反应的活化能为,该反应的ΔH=;
②在反应体系中加入Pt2O+作为该反应的催化剂,则Ea(填“增大”“减小”或“不变”,下同), ΔH 。
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=﹣2070 kJ·mol-1
若有0.5 mol NO被还原,则(填“释放”或“吸收”)的热量为。
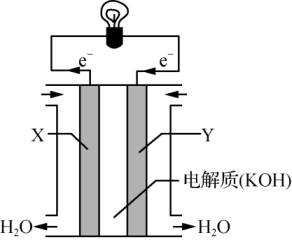
①飞船在光照区运行时,太阳能电池帆板将能转化为能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 , 充电时,阳极的电极反应式为;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增大”“减小”或“不变”)。
②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2 , 其负极的电极反应式为。
为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3 mol H2 , 在500℃下发生发应:CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量浓度(c)随时间变化如图1所示:
CO2(g)+H2(g)⇌CO(g)+ H2O(g) ΔH> 0
将一定量的CO2和H2通入刚性的密闭容器中,CO2的平衡转化率和甲醇的选择率随温度的变化趋势如图所示:
已知:CH3OH的选择性χ=×100%

随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:。

①电解饱和食盐水的化学方程式为;
②氢氧化钠溶液从图中(填“a”“b”“c”或“d”,下同)处收集;
③当有1 mol Na+通过离子交换模时,产生氯气的体积(标准状况下)是。
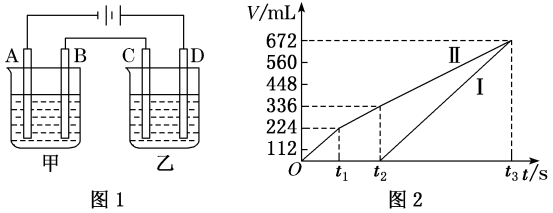
已知一:甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为mol·L-1 , CuSO4的物质的量浓度为mol·L-1。
已知二:乙槽为200 mL CuSO4溶液。
②当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入 (填序号)。
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为 (用NA表示阿伏加德罗常数)。
|
实验组别 |
实验温度/K |
参加反应的物质 |
溶液褪色所需时间/s |
||||
|
KMnO4溶液(含硫酸) |
H2C2O4溶液 |
H2O |
|
||||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
|||
|
A |
293 |
3 |
0.2 |
7 |
1 |
0 |
60 |
|
B |
T1 |
3 |
0.2 |
5 |
1 |
V1 |
80 |
|
C |
313 |
3 |
0.2 |
V2 |
1 |
2 |
t1 |
查阅资料:KMnO4溶液中滴加过量的H2C2O4 , 振荡后溶液由紫色变为无色,反应的离子方程式为:5H2C2O4+2MnO![]() +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
回答下列问题:
小组同学针对这一现象,设计实验进一步探究影响因素,具体情况见下表。

|
方案 |
假设 |
实验操作 |
|
1 |
该反应放热,使溶液温度升高,化学反应速率提高 |
向烧杯中加入3 mL 0.2 mol·L-1 KMnO4溶液和7 mL 1 mol·L-1 H2C2O4溶液, 。 |
|
2 |
|
取3 mL 0.2 mol·L-1 KMnO4溶液加入烧杯中,向其中加入少量硫酸锰固体,再加入7 mL 1 mol·L-1 H2C2O4溶液 |
①补全方案1中的实验操作:;②方案2中的假设为。