 。下列说法错误的是( )
。下列说法错误的是( )
a.石灰乳 b.CaCl2溶液
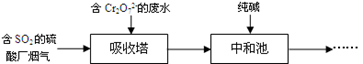
①用SO2处理含铬废水时,利用了SO2的性。
②吸收塔中发生反应的离子方程式为。
离子 | Cr2O72- | Cr3+ | H + | Na + | SO42- |
浓度(mol/L) | a | 0.2×10-6 | 1.2×10-6 | 6.8×10-6 | 3.0×10-6 |
则a= 。

①在导线中电子流动方向为(用a、b表示)
②正极反应式为。
①某些金属氢化物也可做储氢材料,在恒温恒容的密闭容器中,某储氢反应:达到化学平衡。下列有关叙述正确的是。
a.v(放氢)=v(吸氢)
b.吸收y mol H2只需1 mol MHx
c.若通入惰性气体Ar,压强增大,反应速率增大
d.容器内气体压强保持不变
②金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H22LiH
Ⅱ.LiH+H2O=LiOH+H2↑
用锂吸收224 L(标准状况)H2 , 生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为mol。

编号 | 溶液X | 实验现象 |
实验I | 6mol/L稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色 |
实验II | 15mol/L浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色 |

观察到A中有NH3生成,B中无明显现象,A、B产生不同现象的原因是。A中生成NH3的离子方程式是。