
已知:①常温下,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Ni(OH)2]=2×10-15 , 溶液中离子浓度≤1×10-5mol·L-1时认为该离子沉淀完全;
②ZnO是两性氧化物。
回答下列问题:


已知:本实验条件下,氧化性:Cl2>IO>MnO2>I2
回答下列问题:

①实验室用装置A制备Cl2时,适合选用的试剂为。
②实验时,控制向装置B中通入Cl2的速率和用量的常用方法为,若Cl2过量,造成的后果为(用离子方程式表示),向通入过量Cl2所得的溶液中加入一种试剂,可提高I2的产率,该试剂为(填选项字母)。
a.KI b.NaOH c.硝酸
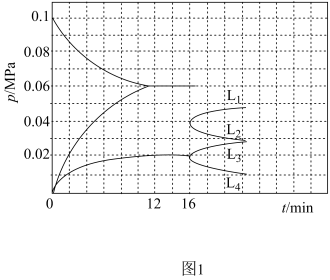
③若用MnO2代替Cl2 , 优点是,(答出一点即可);缺点是分离出的固体残渣中含有少量I2。小组同学用如图3所示装置进行固体残渣中I2的深度萃取,实验时装置D中溶剂受热蒸发,蒸汽沿蒸汽导管上升至装置F,冷凝后滴入滤纸套筒中,与固体残渣接触进行萃取,液面达到虹吸管顶端时,经虹吸管返回烧瓶。装置F的进水口为(填“上口”或“下口”),与常规萃取相比,该萃取装置的优点为。
I.2CH4(g)C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
II.CH4(g)C(s)+2H2(g) ΔH2=+75kJ·mol-1;
III.CO2(g)+C(s)2CO(g) ΔH3=+172kJ·mol-1;
IV.CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=+41kJ·mol-1。
回答下列问题:

①PO的立体构型为。与PO
互为等电子体的分子为(任写一种,填化学式)。
②KTiPO4F中所含元素的第一电离能由大到小的顺序为(用元素符号表示)。
③一些氢化物的沸点如表所示:
氢化物 | PH3 | H2O | HF |
沸点/℃ | -87.5 | 100 | 19.5 |
解释表中氢化物之间沸点存在差异的原因:。



已知:①![]()

②![]()
![]()
③


回答下列问题:
①既能发生银镜反应,又能与FeCl3溶液发生显色反应。
②核磁共振氢谱中有4组吸收峰。
 的合成路线:。
的合成路线:。