
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则滴定终点的现象是。
②晶体中KSCN的质量分数为(保留三位有效数字)

已知:I.CuS、PbS的Ksp分别为6.3×10-36、9.0×10-29;
II.As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:

①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1>0
②2NO2(g)N2O4(g) △H2<0

①下列情况能说明体系达到平衡状态的是(填字母)。
a.混合气体的平均相对分子质量不再改变
b.O2的浓度不再改变
c.NO2的体积分数不再改变
d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0.8MPa,反应开始到10min内N2O4的平均反应速率为MPa·min-1。在该温度下2NO2(g)N2O4(g)的平衡常数Kp=(MPa)-1(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得正=
(NO2)消耗=k正c2(NO2),
逆=2
(N2O4)消耗=k逆c(N2O4),k正、k逆为速率常数且只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=。若将容器的温度改变为T2时,其k正=10k逆 , 则T1T2(填“>”“<”或“=”)。




已知:芳香族化合物与卤代烃在AlCl3催化下可发生如下可逆反应: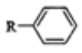 +R′Cl
+R′Cl![]() +HCl
+HCl
 ,
, ①含有酯基;②能发生银镜反应。
其中,核磁共振氢谱显示三组蜂的物质的结构简式为。(任写一种)
 (丙二胺)可用于合成药物。
(丙二胺)可用于合成药物。已知:i.R1HC=CHR2R1CHO+R2CHO
ii.ROH+NH3RNH2+H2O
iii.RCN+2H2RCH2NH2
如图方法能合成丙二胺,中间产物X、Y、Z的结构简式分别是、、。
CH3CH=CHCH3→→
→
→
