(5)
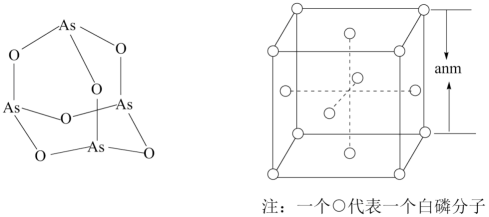
二茂铁是一种含铁的有机化合物,其化学式为Fe(C
5H
5)
2 , 可看作是Fe
2+离子与两个正五边形的环戊二烯负离子(C
5H

)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号π

表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π

),则C
5H

的大π键表示为
,二茂铁为黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是
(填标号)。

A.离子键B.配位键C.δ键D.范德华力
 B.
B.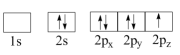
![]() D.
D.![]()