实验小组设计如下装置制备硫代硫酸钠

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2S2O3中S元素的化合价分别为-2和+6
仪器a的名称是。A中发生的化学反应方程式为。
①溶液配制:准确取该硫代硫酸钠样品2.0000g,配制成250mL溶液。
②滴定:向锥形瓶中加入20.00mL0.01mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:
+5I-+6H+=3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2
=
+2I-。
滴定终点现象为,消耗样品溶液的用量为25.00mL,则样品纯度为%(保留1位小数)
①取Na2S2O3晶体,溶解,配成0.2mol/L溶液。
②取4mL溶液,向其中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2: (不考虑空气中氧气氧化)。
设计实验方案:

假设2是。
|
|
胶头滴管 |
现象 |
| 第①组 |
1mL饱和氯水 |
立即出现浑浊 |
| 第②组 |
|
一段时间后出现浑浊,且浑浊度比①组 |
甲醇的制备原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①CO2(g)+H2(g) CO(g)+H2O(g)
kJ/mol
②CO(g)+2H2(g) CH3OH(g)
kJ/mol
根据盖斯定律,该反应的kJ·mol-1 , 反应能在(填“高温”或“低温”)自发进行。
①反应开始到平衡,v(H2)=。
②该温度下的平衡常数K=(mol/L)-2(保留两位有效数值)。
③若上述反应过程中不断升高反应温度,下列图像正确的是。


①生成CH3OH的最佳温度约为。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因:。
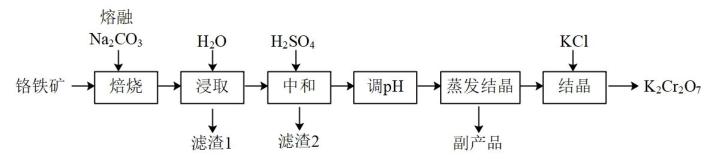

a.50℃蒸发溶剂
b.100℃蒸发溶剂
c.抽滤
d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
f.蒸发至溶液出现大量晶体,停止加热
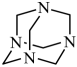 ),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:
),乌洛托品可用于有机合成、消毒、杀虫、军事燃料等用途。回答下列有关问题:

a.苯环上只有两个对位取代基;
b.能与新制Cu(OH)2反应,产生砖红色沉淀;
c.与FeCl3发生显色反应;
d.可发生水解反应。