沉淀 | |||||
恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 | 6.7 | 10.1 |
若浸取液中 , 则须调节溶液pH的范围是(加入
和NaOH时,溶液的体积变化忽略)。


①分子中不同化学环境的氢原子个数比是2:2:2:1。
②苯环上有4个取代基,且有两种含氧官能团。
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

①写出用蚀刻废液制备CuO反应的化学方程式:。
②检验CuO固体是否洗净的实验操作是。
③装置图中装置X的作用是。

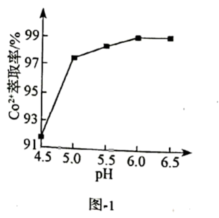
含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图-1所示。水溶液中含砷微粒的物质的量分布分数与pH的关系如图-2所示。已知此温度下,
溶于水,
,
,
。

①一级沉降时,当 , 废水中开始产生沉淀,该沉淀主要成分的化学式为。pH调节到8时,开始产生
沉淀,原因是。
②二级沉降中,保持溶液pH在8~10之间,加入PFS(聚合硫酸铁)形成的胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为。


①加入新生态悬浊液使废水中
转化为
, 反应的离子方程式为。
②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是。