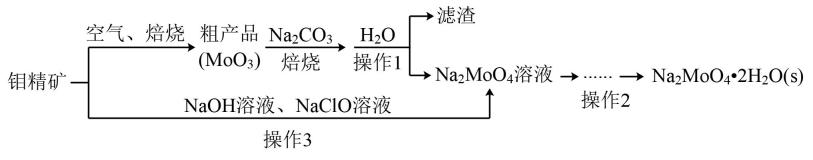
回答下列问题:


已知:①SO2(g)+Cl2(g)=SO2Cl2(1) △H=-97.3kJ/mol。
②SO2Cl2熔点为-54.1℃,沸点69.1℃,常温较稳定。遇水剧烈水解,100℃以上易分解。
回答下列问题:

反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1=-164.9kJ/mol。
反应II:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2kJ/mol
则反应CH4(g)+H2O(g)CO(g)+3H2(g)的ΔH3=kJ/mol。
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
φ(CO2) | 0.25 | 0.23 | 0.214 | 0.202 | 0.200 | 0.200 |
①能判断反应CO2(g)+4H2(g)CH4(g)+2H2O(g)达到平衡的是(填标号)。
A.CO2的消耗速率和CH4的生成速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
D.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO2的转化率为%(结果保留三位有效数字)。


①起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)=mol/(L·min)。
②b点时反应的平衡常数Kp=(kPa)-1(以分压表示)。
③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率(填“增大”“不变”或减小”)。