编号 | 实验操作 | 实验现象 | 解释与结论 |
A | 常温下,等体积等pH的HA、HB两种酸溶液分别与足量的锌反应 | 相同时间内,HB收集到的H2多 | 酸性强弱:HA > HB |
B | 将炽热的木炭加入到浓硝酸中 | 产生红棕色气体 | 木炭与浓硝酸反应生成NO2 |
C | 向盛有2mL 0.1mol/L AgNO3溶液的试管中滴加几滴0.1mol/L NaCl溶液,再向其中滴加0.1mol/L KI溶液 | 先得到白色沉淀后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向1mL 0.5 mol/L KI溶液加入1mL 1mol/LFeCl3溶液,充分反应后向水层滴加KSCN溶液 | 溶液变红 | Fe3+与I-反应是可逆反应 |
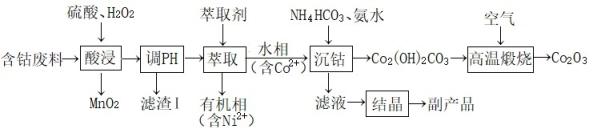
已知:“酸浸”后的浸出液中含的金属阳离子主要有Co2+、Fe3+、Ni2+。
回答下列问题:
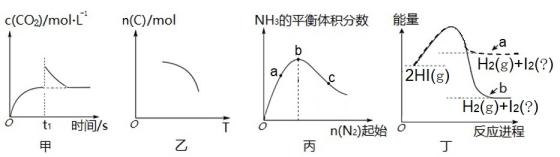
生产过程中发现实际消耗双氧水的量大于理论值,主要原因可能。

a.2 b. 3 c.4 d.5

装置中反应生成N2 , 离子方程式为。
①作为反应物与钙反应生成Ca3N2; ②。
用如下装置测定产品纯度。实验时,打开分液漏斗活塞,加入浓溶液,至不再产生气体,测得
装置反应后增重3.4g(已知Ca3N2摩尔质量为148g/mol,产品中所含的杂质不与NaOH浓溶液反应)。

装置M中发生反应的化学方程式为。
① CO2(g)+H2(g)
H2O(g)+CO (g) ΔH1=+41 kJ·mol-1
② CO(g)+2H2 (g)
CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH =kJ·mol-1
若反应①为慢反应,下图中能体现上述反应能量变化的是 (填标号)。


①P极电极反应式为。
②已知CO2(g)+H2(g)
HCOOH(g) △H = -31.4 kJ·mol-1 。温度为T1℃时, K=2。实验测得:v正=k正c(CO2) c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=k逆;若温度为T2℃时,k正=1.9k逆 , 则T2T1(填“>”、“<”或“=”)。