
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )

H2(g)+Cl2(g)=2HCl(g) △H = -a kJ·mol-1
①
②
③
④



| 反应物 | 起始温度 | 终止温度 | 反应热 | |
| 甲组 | | 15.0 | 18.3 | |
| 乙组 | | 15.0 | 18.1 | |
①某同学利用上述装置做甲组实验,测得 数值偏大,可能的原因是.
A. 溶液一次性迅速倒入
B.做本实验的当天室温较高
C.大小烧杯口不平齐,小烧杯口未接触泡沫塑料板
D.测完盐酸的温度再次测量 溶液温度时,温度计上残留的酸未用水冲洗干净
②两组实验结果差异的原因是.
N2(g)+3H2(g) 2NH3 (g) ΔH<0。反应中 NH3的物质的量浓度的变化情况如图所示:

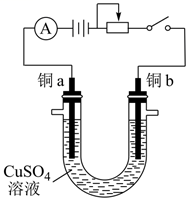
电解前:铜a与铜b的质量分别 和
:
电解后:铜a与铜b的质量分别 和
。
已知: 电子的电量为
,电路中通过的总电量
(t单位为秒)。
则测得的铜元素的相对原子质量为(计算结果保留3位有效数字),写出简要计算过程。
①粗镓与电源极相连(填“正”或“负”)。
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2- , GaO2-在阴极放电的电极反应式。
a.NaCl
b.Fe2O3
c.Cu2S
d.Al2O3

若配制250 mL H2SO4溶液,则需用量筒量取密度为1.84 g·cm-3、质量分数为98%的浓硫酸mL。
仪器A的名称为。
|
实验 次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.6 |
26.6 |
26.6 |
29.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①温度差的平均值为℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3 , 中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=(取小数点后一位)。
③上述结果与-57.3 kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度

回答下列问题:

经计算,氨基甲酸铵分解反应的反应热
(保留四位有效数字)。

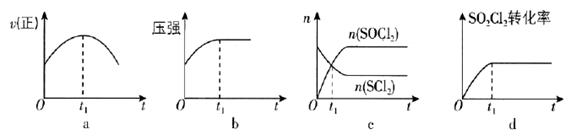
①图中表示c(N2)t的曲线是。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-1 , 则此时v正v逆(填“>”“<”或“=”)。
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=kJ/mol
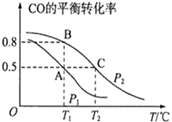
①A、B、C三点的平衡常数KA , KB , KC的大小关系是。
②下列叙述能说明上述反应能达到化学平衡状态的是(填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。

已知:“滤液”中含有的主要离子为 、
、
等。
回答下列问题:
① 中
元素的化合价为。
②在反应物中加入 粉的最主要目的是(填标号)。
A.提供能量 B.防止 被氧化 C.防止结块
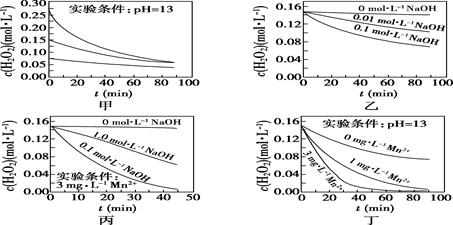
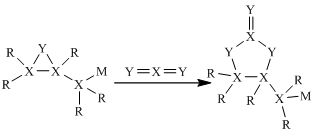
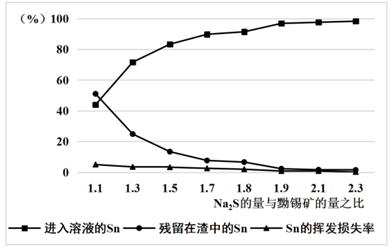
③加入的 的量应为黝锡矿量的2.1倍,结合图示说明其原因。
第一步:
第二步:
①“净化”后溶液应作(填“阳极区”或“阴极区”)电解液。
②“电沉积”过程中,阳极区溶液的 (填“增大”或“减小”或“不变”)。
③“电沉积”结束后,阴极区溶液的主要溶质为(填化学式)。