 与
与 D .
D . 同位素___________。
I.从下列物质中选出合适组号填写在对应空格上。c | d | |||
e | f | g | h |
c处于周期表的第周期族;g的简单阴离子的结构示意图为。

已知:I. (R表示烃基)
II. (R表示烃基)
回答下列问题:
a.CH2=CHCH3→聚丙烯:;
b.C+G→丙酸乙酯:。
a.能与NaHCO3溶液反应放出CO2 b.分子结构中仅含2个甲基
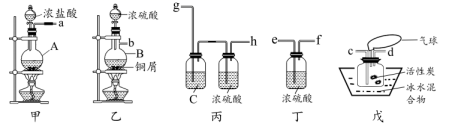
查阅资料:
I.磺酰氯遇水会发生水解反应,生成两种强酸:一种含氧酸、一种无氧酸。
II.磺酰氯在室温下较稳定,但在100℃以上时便会分解产成SO2和Cl2。
III.磺酰氯的熔点℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
回答下列问题:
①要从产物(假定氯磺酸已分解完全,下同)中获得纯净的磺酰氯,可采用的方法是;
②请设计实验证明该方法获得的产物中含有H2SO4:(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)。

已知:I.氢氧化亚铁呈絮状。
II.右表是25℃时生成氢氧化物沉淀对应的pH。
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe2+ | 7.6 | 9.6 |
Fe3+ | 2.7 | 3.7 |
Mn2+ | 8.3 | 9.8 |
Mg2+ | 9.6 | 11.1 |
回答下列问题: