| 选项 | 操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀硝酸,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | Al箔插入稀硝酸中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向盛有某溶液的试管中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |


碱液吸收法:NO+NO2+2NaOH2NaNO2+H2O
NH3还原法: NH3+ NO2 N2+ H2O
①配平NH3还原法的化学方程式。
②以上两种方法中,符合绿色化学的是。
③某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的百分比含量为(计算结果精确到0.1)。
| 实验序号 | 反应温度 | 加入0.1mol/LNa2S2O3溶液 | 加入0.1mol/LH2SO4溶液 | 加入水的体积 | 出现浑浊的时间 |
| ① | 20℃ | 2mL | 2mL | 0 | t1s |
| ② | 40℃ | 2mL | V1mL | 0 | t2s |
| ③ | 20℃ | 1mL | 2mL | V2mL | t3s |
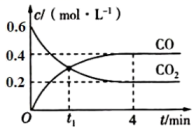
t1时,正反应速率(填“>“”<”或“=”)逆反应速率。
a.降低温度
b.减少铁粉的质量
c.保持压强不变,充入He使容器的体积增大
d.保持体积不变,充入He使体系压强增大
编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
1 | Mg、Al | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Mg、Al | NaOH溶液 | 偏向Mg |
5 | Al、Cu | 浓硝酸 | 偏向Al |
注:①实验均为常温下完成;②电流计指针偏转方向为正极方向。试根据表中实验现象完成下列问题: