
①晶体密度 可以用晶胞的质量除以体积来求算。已知,钛酸钙晶胞的棱长为a pm(
),则钛酸钙晶体密度
(列出计算式)
②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是(填字母序号)
a. b.
c.
① 中N的杂化方式为。
②请从化学键的角度解释由甲胺形成 的过程:。
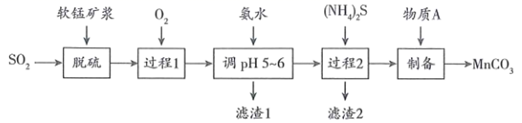
资料:①吸收 后的软锰矿浆中含有
、
、
、
等阳离子;
②金属离子沉淀的pH如下表。
| 金属离子 | | | | | |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 8.2 |
| 电离能 | | | | | |
| | 738 | 1451 | 7733 | 10540 | |
i.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的
结构有两种断键方式:断
键在水中电离出
;断
键在水中电离出
。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一、水化物的 结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响 中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈(填“酸”或“碱”)性,依据是。
②W和X的最高价氧化物对应的水化物中,碱性较强的是(写化学式),结合资料说明理由:。
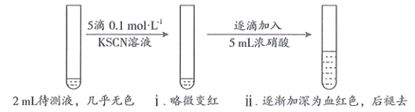
用KSCN检验 的原理是(用离子方程式表示)。
|
步骤 |
操作 |
现象 |
|
Ⅰ |
取2mL待测液,加入5滴0.1 | 溶液颜色无明显变化 |
| Ⅱ | 取2mL待测液, | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
a.几乎未变质 b.部分变质 c.完全变质
从上述探究中获得启发,在用KSCN检验 及进行
还原性验证实验时,需要注意的事项有(至少2条)。