【步骤1】分别在研钵中将上述物质倒烂,加乙醇溶液(乙醇和水的体积比为1∶1)浸泡10分钟。
过滤的目的是。
|
花名称 |
花颜色 |
浸取液颜色 |
在不同溶液中所呈颜色 |
|
|
澄清石灰水 |
食醋 |
|||
|
牵牛花 |
蓝紫 |
红棕 |
黄绿 |
粉红 |
|
月季花 |
大红 |
玫瑰红 |
橙黄 |
粉红 |
|
萝卜花 |
紫 |
紫红 |
黄绿 |
粉红 |
|
丝瓜花 |
黄绿 |
黄绿 |
黄 |
黄 |
上述四种浸取液,最不适合用作酸碱指示剂的(填名称)。
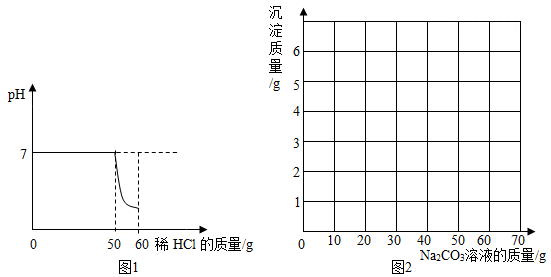
|
Na2CO3溶液质量/g |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
沉淀质量/g |
0 |
1 |
n |
3 |
4 |
5 |
m |
则m=。加入10gNa2CO3溶液时发生反应的化学方程式是。