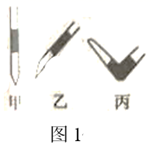
盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作(填“甲”、“乙”、“丙”)。选择酚酞作为指示剂,滴定终点的现象为。
|
滴定次数 |
待测盐酸的体积/mL |
消耗0.100mol/LNaOH溶液的体积/mL |
|
|
滴定前读数 |
滴定后读数 |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
|
第三次 |
25.00 |
0.22 |
26.31 |
则盐酸的物质的量浓度为mol/L。(保留三位小数)
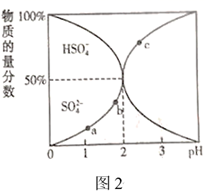
图中a、b、c三点,水电离的 由大到小的顺序分为(用a、b、c表示),pH=3时,
。
![]() +HNO3
+HNO3
![]() +H2O
+H2O

查阅资料可知反应机理如下:
①
② ![]() +
+ →

③?。
回答下列问题:
 )中与硝基相连的碳原子的杂化方式是。上述第③步反应的方程式为。
)中与硝基相连的碳原子的杂化方式是。上述第③步反应的方程式为。
①该反应的化学平衡常数表达式为K=。
②若在一定温度下,将2molNO,1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示。则前20min内用CO2的浓度变化表示的反应平均速率为。
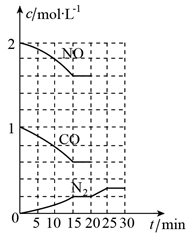
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是(填序号)。
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加 的量