



| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 7.8 | 8.6 | 11.3 | 10.2 | 11.1 |
表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质.依照该规律,请你判断下列反应不能成立的是( )

用所学化学知识判断,下列说法正确的是( )


①A+B ②A+E
③A+D ④ D+E



③2NaHCO3=Na2CO3+H2O+CO2↑。


①检查装置气密性,在锥形瓶内加入样品10.6g和适量的水并放出热量,并连接好仪器;
②打开分液漏斗活塞,将稀盐酸缓缓注入锥形瓶中,使样品恰好完全反应,准确测得量筒内共收集到1100mL的水(装有水的广口瓶的水面上方铺有一层油);
③拆下装置后,往锥形瓶内的溶液中注入足量硝酸银溶液,至沉淀完全,经过滤、洗涤和干燥后,称量沉淀质量。
注:本实验条件下,二氧化碳的密度2g/L。
【查阅资料】
①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应。

分析曲线甲,M 点电导率几乎为零,请从离子角度分析原因 。
交流与反思:通过以上实验的比较分析,让我们对溶液中复分解反应实质有了更深层的理解,即。

综合分析有关实验的现象回答:
①无色滤液b一定呈(填“酸”、“碱”或“中”)性;
②上述实验所得无色滤液b中可能存在的溶质是,请你设计实验证明该溶质是否存在。你的实验操作是。
【查阅资料】
⑴水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
⑵了解到某些难溶性盐的溶解能力和颜色,其中AgI是一种难溶于水的黄色沉淀。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】
|
试剂1 |
试剂2 |
混合前温度/℃ |
混合后温度/℃ |
|
|
35毫升稀盐酸 |
25毫升Na2CO3溶液 |
20.0 |
第1次 |
24.2 |
|
第2次 |
24.0 |
|||
|
第3次 |
24.4 |
|||
请你帮助填写相关内容:
|
实验1 |
实验2 |
实验3 |
|
|
样品质量/g |
20 |
20 |
20 |
|
BaCl2溶液质量/g |
30 |
60 |
90 |
|
电子天平示数/g |
42.33 |
44.66 |
44.66 |


试验次数 | 1 | 2 | 3 |
加入碳酸氢钠溶液质量(g) | 25 | 50 | 100 |
锥形瓶内剩余物质质量(g) | 123.9 | 147.8 | 196.7 |
[研究方案]先称取13、3g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14、6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。从而进一步确定样品中NaOH的变质程度。
[解决问题]实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示。
填写下表:(计算结果保留小数点后一位)
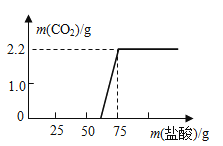
Na2CO3的质量/g |
|
变质NaOH的质量/g | |
NaOH的变质程度 |