
分液漏斗及2号气瓶中盛放浓度为150g·L-1的NaClO2溶液,1号气瓶中盛放6mol·L-1的H2SO4溶液,3号、4号、5号、6号气瓶中盛放冰水。回答下列问题:
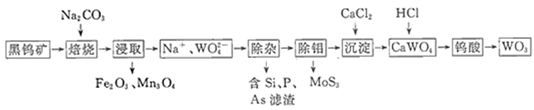
回答下列问题:

ICO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1<0;
IICO2(g)+H2(g) CO(g)+H2O(g)△H2>0。
控制CO2和H2初始投料比为5:11,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
| 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
[备注]甲醇选择性为转化的CO2中生成甲醇的百分比。
表中实验数据表明,在相同温度下,不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。


|
物质 |
熔点/K |
沸点/K |
分解温度/K |
|
NH3 |
195.3 |
239.7 |
1073 |
|
PH3 |
139.2 |
185.4 |
713.2 |
NH3的熔、沸点均高于PH3的原因是;PH3的分解温度高于其沸点,其原因是。

①其化学式为。
②基态锡原子的价电子排布式为。
该晶体中距离Sn原子最近的Cu原子有个。
③若晶体密度为8.82g·cm-3 , 距离最近的Cu原子核间距为pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。

回答下列问题:
(合成路线常用的表示方式为:A B……
目标产物)