| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
| 通入 | 褪色 | 褪色 | 褪色 |
| 通入 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
已知: (CuS为黑色固体);
可燃
下列说法错误的是( )

①将虚线框a内的仪器补充完整(夹持装置可省略)。
②b为尾气吸收装置,其中的试剂为。

①步骤Ⅰ反应的离子方程式为。
②生物浸出法的总反应的氧化剂是。
①下列说法正确的是(填字母序号)。
a.过程i到过程ⅲ均为氧化还原反应
b. 既有氧化性,又有还原性
c. 能与NaOH反应生成
和
d.Se与 化合比S与
化合容易
②过程ⅲ中使用的还原剂为 ,对应产物是
。理论上,过程i消耗的
与过程消耗的
的物质的量之比为(工业硒中杂质与
的反应可忽略)。
| 实验装置 | 实验编号及试剂 | 实验现象 |
| | ① | 阳极:产生有刺激性气味的气体 阴极:电极上有红色固体析出 |
| ② | 阳极:产生有刺激性气味的气体 阴极:电极上有少量红色固体和白色固体析出,同时电极附近液体变为黑色 |
查阅资料:
i.阴极附近的白色固体为 ;
ii. 在水溶液中单独存在时不稳定,容易发生反应:
。
结合资料分析CuCl产生的路径有如下两种可能:
路径1:阴极发生电极反应分两步:
i.
ⅱ. ,同时伴随反应
,生成白色沉淀。
进一步查阅资料,提出以下猜想。
猜想1.生成氢氧化铜,进而转化为极细小的氧化铜;
猜想2.生成铜的速率快,形成黑色纳米铜;
猜想3.发生反应 (棕黑色)。
若猜想1成立,则阴极一定还存在的电极反应是。
取2mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
| 实验编号 | ③ | ④ | ⑤ |
| 加入试剂 | 4mL浓 | 4mL浓HCl | |
| 实验现象 | 溶液变澄清,呈绿色,试管口有浅红棕色气体生成 | 黑色液体颜色变深 | 溶液变澄清,呈绿色,同时出现少量白色沉淀 |

已知:①不同铅化合物的溶度积(25℃): ;
②PbSiF6和 均为能溶于水的强电解质。
过程i中,物质a表现(填“氧化”或“还原”)性。

下列说法正确的是(填字母序号)。
a.阴极为粗铅,纯铅在阳极析出
b.电解产生的阳极泥的主要成分为Cu和Ag
c.工作一段时间后,需要补充Pb2+以保持溶液中c(Pb2+)的稳定

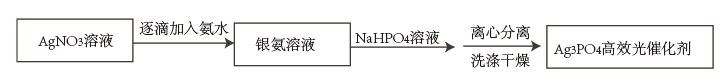
已知:i.Ag3PO4难溶于水,可溶于硝酸;
ii.Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii.银氨溶液中存在:
配制银氨溶液时的反应现象是。
□ +□+□=□NH3+□+□
已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发反应。a.
Ag3PO4光催化CO2制备甲醇可实现“碳中和”,a的后续反应: ,
,则由CO2制备甲醇的总反应的化学方程式为。
注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用Ag3PO4依次降解三份相同的废水,测得3次降解过程中RhB的残留率( :即时浓度与起始浓度之比)随时间变化的曲线如图。
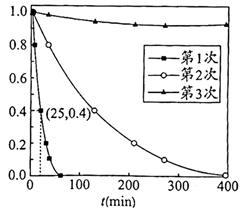
①下列说法正确的是(填字母序号)。
a. 和
是降解RhB的重要氧化剂
b.第1次使用后Ag3PO4的光催化性能降低
c.该实验条件下,Ag3PO4使用两次即基本失效
②第1次光降解时, 内的反应速率为
(废水中RhB初始浓度
为
,RhB的摩尔质量为
)