Ⅰ.共价键的键能是指形成1mol某种共价键的过程中所放出的能量或断裂1mol某种共价键的过程中所吸收的能量。显然共价键的键能越大,该共价键越牢固,含有该共价键的分子越稳定。如H—H键的键能是436kJ·mol-1 , 是指使1molH2分子变成2molH原子需要吸收436kJ能量。
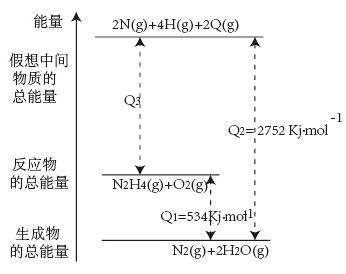
1molN2H4(g)和1molO2(g)生成2molN原子、4molH原子、2molO原子的过程中(填“吸收”或“放出”)kJ能量。
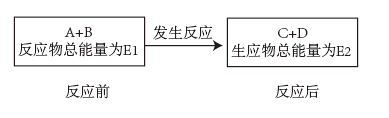
若E1>E2 , 则该反应为(填“放热反应”或“吸热反应”)。
①将容器的体积变为3L,化学反应速率。
②加入少量的碳,化学反应速率。

①a=(保留两位有效数字);
②7min时,正反应速率(填“>”、“<”或“=”)逆反应速率,此时混合气体的平均相对分子质量为(保留三位有效数字)。