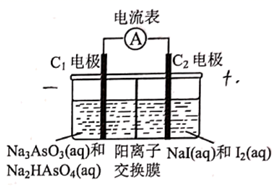
已知:①
②
保持温度 不变,在
的刚性容器中充入适量
与
发生反应
达到平衡。从
时的平衡状态升高温度,上述平衡体系中各物质的物质的量随温度的变化如下图所示。
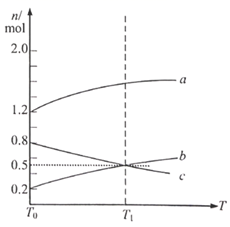
A. 与
质量比不再变化 B.
与
的分子总数保持不变
C.混合气体的密度保持不变 D. 的体积分数不再变化

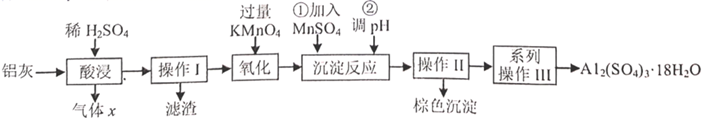
i.在C中加入 和
的浓溶液混合均匀,保持
以下,将A产生的
缓缓通入C中,不断搅拌至溶液呈深紫红色即得
的混合液。
ii.取下C继续加入 固体至饱和,过滤取滤液。
ⅲ.在滤液中加入饱和 溶液,保持温度不变,不断搅拌至有大量黑色沉淀生成,过滤取滤渣。
ⅳ.将滤渣用 溶液溶解,再加入饱和
溶液,冰水冷却析出晶体,过滤后用95%乙醇洗去碱液,再用乙醚洗涤即得到产品。
已知一定条件下, 时相关物质溶解度如下表:
| 物质 | | | | | | |
| 溶解度 | 36.1 | 87.3 | 108.6 | 112 | 138.5 | 38.2 |
a. (浓) b.
(浓)
c. (浓) d.
溶液

已知:金属离子浓度为 时生成氢氧化物沉淀的
| | | | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |