| 选项 | 实验操作和现象 | 结论 |
| A | 向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温 | 盐酸与氢氧化钠的反应为放热反应 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| 体积 | 投料 | 200℃时 HCl平衡转化率 | 400℃时 HCl平衡转化率 | |
| 容器I | 1L | 4mol HCl(g)、1mol O2(g) | 90% | 75% |
| 容器II | 2L | Xmol HCl(g)、2mol O2(g) | α1 | α2 |
工业级 溶液
![]()
![]()
![]()
![]()
除杂。①向硫酸镁溶液中加入 ,加热、保持溶液温度在
,将
转化为
沉淀,反应后滤液的
(填“增大”、“不变”或“减小”);
②调节滤液的 ,使溶液呈弱碱性,向其中加入
,将
转化为
沉淀,写出该反应的离子方程式。
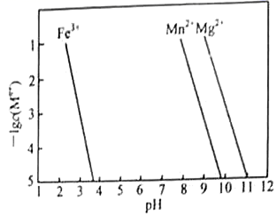
③ (
、
、
)转变为氢氧化物沉淀的
如图。除杂时未采取将
直接转化为
的原因是。
途径Ⅱ 以磷肥副产物 溶解
,充分反应后过滤、得
溶液,浓缩得
,
条件下煅烧得
。

已知:酸性环境下,KMnO4既能氧化Fe2+ , 又能氧化C2O ,自身被还原为Mn2+。
①计算样品中FeC2O4·2H2O的质量分数。 (写出计算过程)
②若滴定过程中,酸度控制不当,MnO 部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。
①写出生成SrS的化学反应方程式:。
②设计以黑灰为原料,制取SrSO4的实验方案:。
(已知:SrS易溶于水,易水解。水浸时的浸取率随温度变化如下图。实验中锶元素需充分转化SrSO4 , 必须使用的试剂:蒸馏水、3mol·L-1H2SO4和NaOH溶液)。
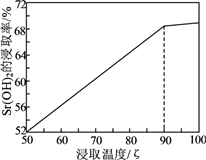

①已知:298K时,相关物质的相对能量如图:则ΔH=。
②850℃,恒压条件下,常需要通入大量水蒸气,目的是。
①“乙烷催化裂解法”制备乙烯时,常会发生积碳反应:C2H6(g) 2C(s)+3H2(g),生成的碳会附着在催化剂的表面,降低催化剂的活性,而“乙烷氧化裂解制乙烯”时,很少有积碳,可能原因是。
②探究该反应的适宜条件,得到下图数据:

已知:C2H4的选择性:指转化的C2H6中生成C2H4的百分比;乙烯的收率=C2H6的转化率×C2H4的选择性。
图甲:表示其它条件相同,不同温度条件下,组成相同的原料气,反应相同的时间,测得的C2H6的转化率、C2H4的选择性以及乙烯的收率与温度的关系;
图乙:表示其他条件相同,C2H6的转化率、C2H4的选择性以及乙烯的收率随原料气中 的变化情况。
用该方法制备乙烯应该选择的适宜条件为:温度; =。
