下列相应说法错误的是( )

①配制浓度均为1mol/L的盐酸和醋酸溶液;
②用量取10.00mL 1mol/L的盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应,读出量筒中水的体积为V mL.

(标准状况)如下表:
试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
从表中数据分析,实验室制氨气的产率最高的其原因是.
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
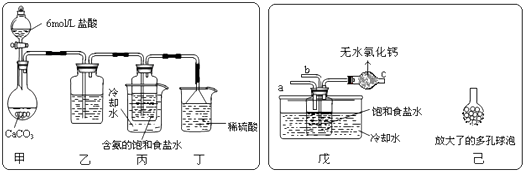
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从管通入气体,再从管中通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是;

a.E是一种线型高分子 b.由A生成E的反应属于加聚反应
c.E的相对分子质量为72 d.E用作一次性快餐盒有助于减少白色污染
![]()
②苯在AlCl3催化下能与酰卤发生如下反应:

有机物E可经下述路线合成:

E与钠反应放出氢气,但通常不能被催化氧化生成醛或酮;E与硫酸共热到一定温度可得到F和G.F分子中所有碳原子均可共处于同一平面上,而G却不可.回答下列问题: