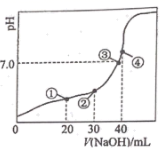
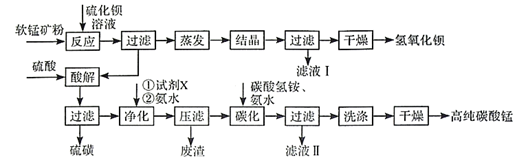
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | | | | |
回答下列问题
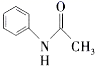 )在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过本胺(
)在工业上可作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过本胺( 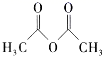 )反应制得。
)反应制得。 已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为114℃,易溶于有机溶剂。在水中的溶解度如下。
| 温度 | 20 | 25 | 50 | 80 | 100 |
| 溶解度/(g/100g水) | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):
Ⅰ.粗乙酰苯胺的制备。将7mL(0.075mol)乙酸酐放入三口烧瓶c中,在恒压滴液漏斗a中放入5mL(0.055mol)新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流30min,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有100mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用( )洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。

Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入250mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,( ),称量产品为3.28g。
回答下列问题:
A.乙醇 B.CCl4 C.冷水 D.乙醚
①CH4(g)+H2O(g)⇌CO(g)+3H2 (g) △H1= 206kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2= - 4 1 kJ•mol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)⇌2CO(g)+2H2(g) △H3

I.根据图1,在 ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 。
II.根据图,2随着反应温度和反应物中 的提高,体系中反应填①、②、③)逐渐占据主导。若 850℃、
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=。
①C2H2分子中 键与
键的数目之比为;碳原子的杂化方式为。
②写出与Cu2C2中阴离子C22-互为等电子体的一种分子和一种离子。
①形成的络合物中提供孤对电子的原子为(填元素符号)。
②乙二胺中所含元素的电负性由大到小的顺序为;乙二胺在水中溶解度较大的原因为。
