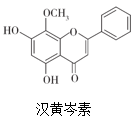
已知:Fe的活泼性强于Ni。
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeCl3溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是。
Ⅰ.向盛有0.1 mol•L-1FeCl3溶液的三颈瓶中,滴加一定量0.1 mol•L-1Na2S溶液,搅拌,能闻到臭鸡蛋气味,产生沉淀A。
Ⅱ.向盛有0.1 mol•L-1 Na2S溶液的三颈瓶中,滴加少量0.1mol•L-1 FeCl3溶液,搅拌,产生沉淀B。
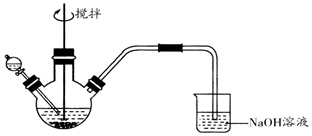
已知:①FeS2为黑色固体,且不溶于水和盐酸。②Ksp(Fe2S3)=1×10-88 , Ksp(FeS2)=6.3×10-31 , Ksp[Fe(OH)3]=1×10-38 , Ksp(FeS)=4×10-19
回答下列问题:
实验一、探究A的成分
取沉淀A于小烧杯中,进行如下实验:

试剂X是。由此推断A的成分是(填化学式)。
取沉淀B于小烧杯中,进行如下实验:

向试管a中加入试剂Y,观察到明显现象,证明溶液中存在Fe2+ . 试剂Y是,明显现象是。由此推断B的成分是(填化学式)。
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ∆H=+213.7kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ∆H=−33.5kJ·mol-1

①约650℃之前,脱羧基反应活化能低,反应速率快,很快达到平衡,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是。
②保持其他条件不变,在乙酸气中掺杂一定量的水,氢气产率显著提高而CO的产率下降,请用化学方程式表示。
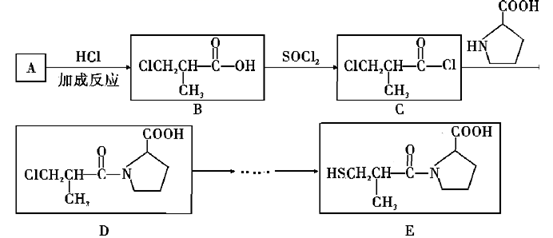
a.卡托普利的水溶液呈酸性 b.在氧气中充分燃烧的产物中含有SO2
c.E的分子式为C9H16NO3S d.E存在属于芳香族化合物的同分异构体