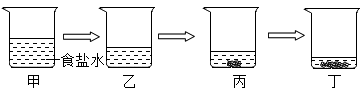
 B .
B .  C .
C .  D .
D . 
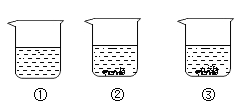
| 实验序号 | 水的质量(一) | 加入NaCl的质量(g) | 溶液的质量(g) |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |

|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
氯化铵溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
|
氯化钠溶解度/g |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
温度(℃) |
t1 |
t2 |
t3 |
|
物质A(克) |
36.0 |
36.2 |
37.3 |
|
物质B(克) |
31.6 |
36.2 |
110.0 |
|
物质C(克) |
0.165 |
0.135 |
0.076 |

| 选项 | 操作 | 目的 |
| A | 用剩的食盐放回原试剂瓶 | 避免浪费 |
| B | 天平调平后在左、右托盘各垫一张相同的纸 | 保证称取的食盐质量更准确 |
| C | 用50mL量筒替代天平来量取所需的水 | 更加简便 |
| D | 溶解时用玻璃棒搅拌 | 增强食盐的溶解能力 |
 B . 转移氯化钠
B . 转移氯化钠  C . 量取水
C . 量取水  D . 配好后装瓶
D . 配好后装瓶 
①再加入10g硝酸钠
②蒸发掉一半溶剂
③蒸发掉50g水
④再加入100g10%的该溶液
⑤与100g30%的该物质溶液混合。其中正确的有( )

溶解。将称量好的硝酸钾和蒸馏水混合溶解。
