一、<b >选择题(共</b><b >7</b><b>小题,每小题</b><b>3</b><b >分,满分</b><b >21</b><b>分)</b>
-
1.
某有机物由C、H、O三种元素组成,分子球棍模型如图所示.关于该有机物叙述正确的是( )

A . 分子式为C11H9O3
B . 不能使溴水褪色
C . 属于芳香族化合物
D . 不能与Na0H溶液反应
-
2.
用右图所示装置进行如下实验,能达到实验目的是( )

A . 瓶中盛满水,从B口进气,用排水法收集NO2
B . 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C . 从B口进气,用排空气法收集CO2
D . 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
-
3.
NA为阿伏加德罗常数的值.下列说法中,正确的是( )
A . 常温常压下,l.6gCH4中含有共价键总数为0.4NA
B . 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA
C . 1 L0.1mol•L﹣1的醋酸中含有H十离子数为0.1NA
D . 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA
-
4.
下列实验操作、现象及由此得出的结论均正确的是( )
选项
| 实验操作 | 现象 | 结论 |
A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
B | 将0.1mol•L﹣1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L﹣1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
A . A
B . B
C . C
D . D
-
5.
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q |
原子半径/(10﹣10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | ﹣﹣ |
最低负价 | ﹣﹣ | ﹣1 | ﹣﹣ | ﹣﹣ | ﹣3 | ﹣2
|
下列叙述不正确的是( )
A . 由元素X和Q组成的化合物不可能含有共价键
B . X,Z,R的最高价氧化物对应水化物可彼此反应
C . Y﹣半径比Q2﹣半径大
D . M(OH)2的碱性比XOH的碱性弱
-
6.
如图所示的电化学装置中,电极I为Al,其他电极均为Cu,则下列说法正确的是( )

A . 电子流向:电极Ⅳ→(A) →电极I
B . 电极Ⅲ的电极反应:2H2O-4e-=4H++O2↑
C . 电极Ⅱ的质量减少,电极Ⅲ的质量增加
D . 三个烧杯中的SO42﹣浓度都始终保持不变
-
7.
某温度下,0.200mol•L
﹣1的HA溶液与0.200mol•L
﹣1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是( )
微粒 | X | Y | Na+ | A﹣ |
浓度/(mol•L﹣1) | 8.00×10﹣4 | 2.50×10﹣10 | 0.100 | 9.92×10﹣2 |
A . 0.1mol•L﹣1HA溶液的pH=1
B . 该温度下Kw=1.0×10﹣14
C . 微粒X表示OH﹣ , Y表示H+
D . 混合溶液中:n(A﹣)+n(X)=n(Na+)
二、<b >解答题(共</b><b >3</b><b>小题,满分</b><b>43</b><b >分)</b>
-
8.
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2 SnCl4 , Sn也可与HCl反应生成SnCl2 , 已知:
SnCl4 , Sn也可与HCl反应生成SnCl2 , 已知:
物质 | 摩尔质量/(g•mol﹣1) | 熔点/℃ | 沸点/℃ |
Sn | 119 | 232 | 2260 |
SnCl2 | 190 | 246.8 | 623
|
SnCl4 | 261 | ﹣30.2 | 114.1 |
MnO2 | 87 | 535(分解) | ﹣ |
某同学设计的相关实验装置图如图:
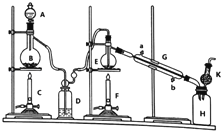
-
(1)
A中浓盐酸与B中物质进行反应,化学方程式为 .
-
-
-
(4)
为避免E中副反应的发生,对装置需要改进的措施是.
-
-
(6)
当要结束实验时,不能首先进行的操作是.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
-
(7)
若将B中的固体换成,并将除A和B以外的器皿去掉,反应可制备SnCl2 .
-
(8)
实验结束后,若得到的SnCl4为13.05g,至少消耗 g MnO2 . 为了避免尾气污染,需要改进的措施是 .
-
9.
过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3﹣与H2O2复合而形成的一种固体放氧剂,可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%=  ×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1:
×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1: 
回答下列问题:
-
(1)
过碳酸钠受热易分解,写出反应的化学方程式.
-
(2)
稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是(填字母).a.MnO2b.KI c.Na2SiO3d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如图1所示.要使产品达到优等品且产率超过90%合适的反应温度范围是.
③“结晶”时加入NaCl的目的是,其作用原理是.
-
-
(4)
产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L
﹣1硫酸溶解完全,立即用0.02000mol•L
﹣1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO
4溶液的平均体积为26.56mLo另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO
4溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响及其原因.
③该样品的活性氧含量为%,表明该样品(填“是”或“不是”)
-
10.
氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
-
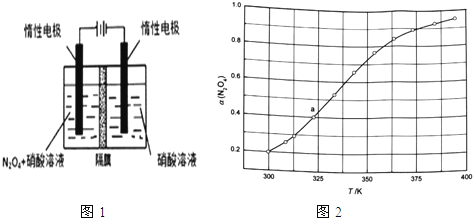
(1)
从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .
已知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)⇌N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
-
(2)
从N
2O
5在一定条件下发生分解:2N
2O
5(g)═4NO
2(g)+O
2(g).某温度下测得恒容密闭容器中N
2O
5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
-
(3)
从N2O4与NO2之间存在反应N2O4⇌2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)⇌2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
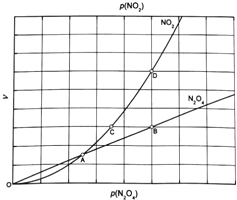
③对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .
三、<b >[化学</b><b >-</b><b>选修</b><b>2</b><b >:化学与技术</b><b >]</b><b >((共</b><b >1</b><b>小题,满分</b><b>15</b><b >分)</b>
-
11.
工业生产玻璃会产生大量的窑炉气(含SO2和氮氧化物等).为减少环境污染,某工厂生产玻璃与处理窑炉气的工艺流程如下: 
-
(1)
生产普通硅酸盐玻璃的主要原料是石英砂、 和石灰石。其中,石灰石参与的反应方程式是 。
-
(2)
窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,该反应方程式为 ;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,原因是 。
-
(3)
“脱硫塔”中反应形成的灰分,除亚硫酸钠和氮的含氧酸盐外,主要还有 ;用于喷雾的火碱溶液应选用软化水配制,原因是 。
-
(4)
在“脱硝装置”中,催化剂设计成蜂窝而韭平板状结构.原因是 。氧气在脱硝过程中的作用是
-
四、<b ></b><b >[</b><b>化学</b><b>-</b><b >选修</b><b >3</b><b>:物质结构与性质〕(共</b><b>1</b><b >小题,满分</b><b >15</b><b>分)</b>
-
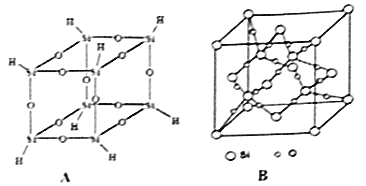
12.
倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示,回答下列问题:
-
(1)
基态Si原子的最外层电子排布式为,其中成对电子之间的主要区别是
-
(2)
图A分子中H的化合价为,Si原子采用杂化,形成的极性共价键类型为;键的极性Si﹣H键Si﹣O(填空“>”、“<”、“=”)
-
(3)
图A分子结构中,一个硅原子被3个元环共有,硅的配位数为,该分子的分子式为
-
-
(5)
每个SiO2晶胞含有Si原子的个数为;已知SiO2晶体为面心立体结构,晶胞参为anm,阿伏加德罗常数的值为NA , 则SiO2晶体的密度为g•cm﹣3 .
五、<b ></b><b >[</b><b>化学</b><b>-</b><b >选修</b><b >5</b><b>:有机化学基础〕(共</b><b>1</b><b >小题,满分</b><b >0</b><b>分)</b>
-
13.
中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖.由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如下: 
已知氢化青蒿素的分子式为C15H22O4 . 回答下列问题:
-
-
(2)
反应①中,NaBH4的作用是 .
A . 氧化剂
B . 还原剂
C . 催化剂
D . 溶剂
-
-
(4)
青蒿琥酯能够发生的反应类型有 .
A . 酯化化反应
B . 水解反应
C . 还原反应
D . 加聚反应
-
(5)
参照H2Q的表示方式,写出反应②的化学方程式 .
-
(6)
从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E.合成过程中,有机原料除H2Q、  外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
 SnCl4 , Sn也可与HCl反应生成SnCl2 , 已知:
SnCl4 , Sn也可与HCl反应生成SnCl2 , 已知:
![]() ×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1:
×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1: 





![]() 外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .