
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3min内该反应的平均反应速率为.
②能说明该反应已达到平衡状态的是.
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变
d.容器内压强保持不变
有机物A | 有机物B | 有机物C | 有机物D |
①可用于果实催熟 ②比例模型为 | ①由C、H两种元素组成 ②球棍模型为 | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
根据表中信息回答下列问题:
a.A,B均可使酸性KMnO4溶液褪色
b.A,B分子中所有的原子在同一平面内
c.等质量的A,B完全燃烧,消耗氧气的量相同
d.A,B分子均含有官能团碳碳双键,能发生加成反应
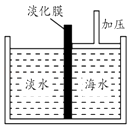
a.溶质质量 b.溶剂质量 c.溶质的质量分数
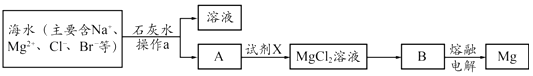
①操作a的名称是.
②写出B冶炼金属镁的化学方程式.
步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴.
①步骤一和步骤二的目的是.
②步骤二中发生反应的化学方程式为.
某化学兴趣小组在实验室中模拟上述过程,设计的模拟装置如下:

根据设计要求回答:
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4