实验室用加热无水醋酸钠与碱石灰固体混合物来制取并收集一瓶较为纯净的甲烷气体,则应选用图中的装置(填字母)。
A. 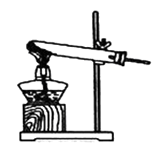 B.
B. 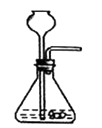 C.
C. 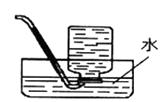 D.
D. 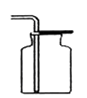 E.
E. 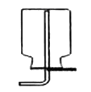
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行.
②了解到某些难溶性盐的溶解能力和颜色.
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成.
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀.
【分析讨论】( 1 )为什么要加入过量的NaCl溶液?请说明理由.
( 2 )写出加入少量KI溶液后发生反应的化学方程式.
( 3 )该反应能发生的原因是AgI在水中的溶解能力AgCl(选填“大于”、“等于”或“小于”).
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应.
小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。(实验中操作正确,O2的密度为ρg/cm3)
| 实验序号 | 1 | 2 | … |
| m1(MnO2)/g | |||
| m2(KClO3)/g | |||
| m3(试管)/g | | ||
| m4(试管+加热后剩余固体)/g | | ||
| 量筒内收集气体的体积V/cm3 | |

第1步:2MnO2+2KClO3 2KMnO4+Cl2↑+O2↑
第2步:2KMnO4 K2MnO4+MnO2+ O2↑
第3步:K2MnO4+ Cl2 2KCl+ MnO2+ O2↑
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因。
为了进一步确定“银粉”是铝还是锌,学习小 组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。
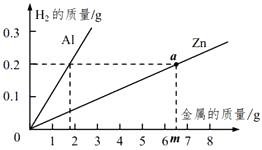
取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是。计算实验中所用稀盐酸的溶质质量分数。
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
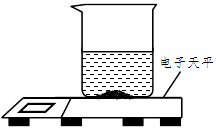
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
实验一 | 实验二 | 实验三 | |
反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
反应前固体样品质量(克) | 4 | 8 | 12 |
反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
已知实验中发生的化学反应: NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑
①取10克样品于烧杯中,加入蒸馏水充分溶解,配制成60克溶液;
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应;
③将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为14.35克。
请根据上述实验回答: (相关反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3)
反应前 | 反应后 | |
烧杯和样品溶液总质量/g | 加入的氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
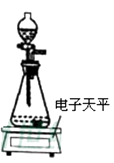
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1 | 反应后总质量m2 |
371.84g | 371.24g |
回答下列问题: