TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | ﹣69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | ﹣ | 微溶 | 难溶 | |
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣220.9kJ•mol﹣1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:.
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的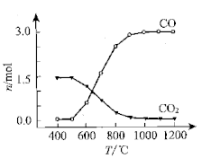
△H0(填“>”“<”或“=”),判断依据:.
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有.
精制过程:粗TiCl4经两步蒸馏得纯TiCl4 . 示意图如下:
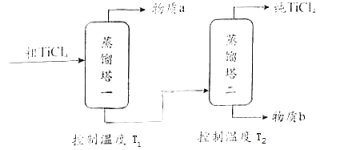
物质a是,T2应控制在.
SCR(选择性催化还原)工作原理:
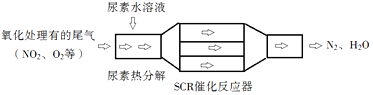
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式:.
②反应器中NH3还原NO2的化学方程式:.
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成:.
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是.
NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
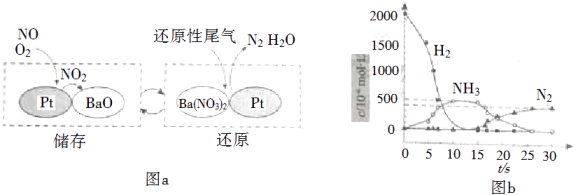
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是.
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是.
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整:.
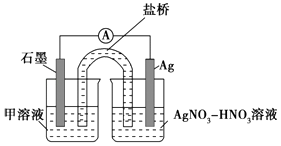
向硝酸酸化的0.05mol•L﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有.
针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是,操作现象是.