( i)MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
( ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol•L﹣1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
①方程式( i)配平后H2C2O4的计量系数为.
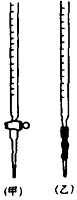
②0.020mol•L﹣1KMnO4标准溶液应置于(填“甲”或“乙”)滴定管中;滴定终点的颜色变化是.
③你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因.“能”的计算结果或“否”的原因说明.
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是.
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗.
E.①=③>②F.①>②=③G.①=②>③H.①=②<③
①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.
