②1/2N2(g)+1/2O2(g)=NO(g) △H2=-89.75kJ/mol
③2NO(g)+O2(g)=2NO2(g) △H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为。
①0~10min内,CO的平均反应速率v(CO)=;
②若容器中观察到 ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡(填“右移”或“左移”或“不移动”)。
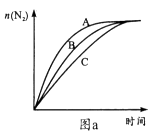
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
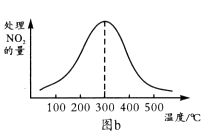
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因(假设该温度范围内催化效率相同)。
实验I 新制Cu(OH)2与葡萄糖反应
①该实验现象说明;
②该原理可用于检测糖尿病患者血液中的含量。
实验II 新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 。 | ②开始时红色固体颜色变化缓慢的原因是。 ③所得无色溶液中主要阴离子为。 |
反思:将表中SO2换为NO2是否能观察到相同现象? 回答并解释:。
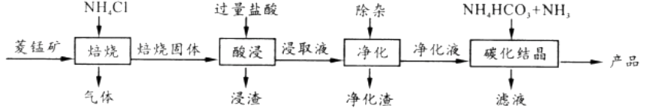
已知:MnCO3+2NH4Cl MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
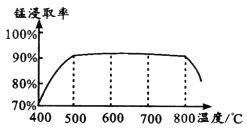
焙烧时适宜温度为;800℃以上锰的浸取率偏低,可能原因是。
②加氨水调pH,生成沉淀主要是;
③加入NH4F,除去Ca2+、Mg2+。
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4 , 发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I- , 滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是。
②假设杂质不参与反应,则产品纯度为。
①苯环上有3 个取代基; ②为芳香族化合物且属于酯类;
③遇氯化铁溶液显紫色; ④苯环上一氯代物有2 种。
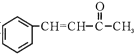 ),参照上述路线,设计路线。
),参照上述路线,设计路线。