①“歧化反应”的化学方程式为。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是。

已知:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ•mol-1
N2(g)+O2(g)⇌2NO(g) △H=+180kJ•mol-1
脱硝反应:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g)的△H=kJ•mol-1

①下列可提高氨气产率的途径是。
A.尽量提高反应温度
B.对原料气适当加压
C.采用适当的催化剂
D.将氨气液化,不断移出液氨
②上图所示平衡体系中当NH3的物质的量分数分别为0.549和0.429时,该反应的平衡常数分别为K1和K2 , 则K1K2(填写“>”,“<”或“=”)。当NH3的物质的量分数为0.600时,容器的体积为2L,此时该反应的化学平衡常数K=。

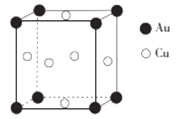
①反应I中氧化剂与还原剂的物质的量之比为。
②写出该过程的总化学反应方程式。

①图中b应连接电源的(“正极”或“负极”)。
②阳极的电极反应式为。
采用蒸馏法,蒸馏装置如图所示。

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120mol•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
仪器M的名称为。
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
步骤①中,判断BeCl 溶液已过量的实验操作和现象是。
回答下列问题: