已知合成硫脲的反应原理为:
回答下列问题:
步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应:
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应:
步骤4:待步骤3反应充分后加稀硫酸,发生反应:
步骤5:以淀粉溶液作为指示剂,用1.00的
, 标准液滴定步骤4得到的溶液,发生反应:
, 平行滴定三次,消耗
标准液的平均体积为20.00mL
①判断达到滴定终点的实验现象是。
②产品中硫脲的含量为。
③下列操作会导致测得的硫脲含量偏高的是(填字母)。
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装标准液的试管未润洗
D.滴定开始时俯视读数,达到滴定终点时仰视读数
固体已知:①常温时,有关物质如下表:
物质 | ||||
②常温时,的溶度积
, 该数值随温度升高而减小。
①补充完整上述离子方程式;
②旧生产工艺用盐酸进行“酸浸”,但易造成环境污染,原因是。
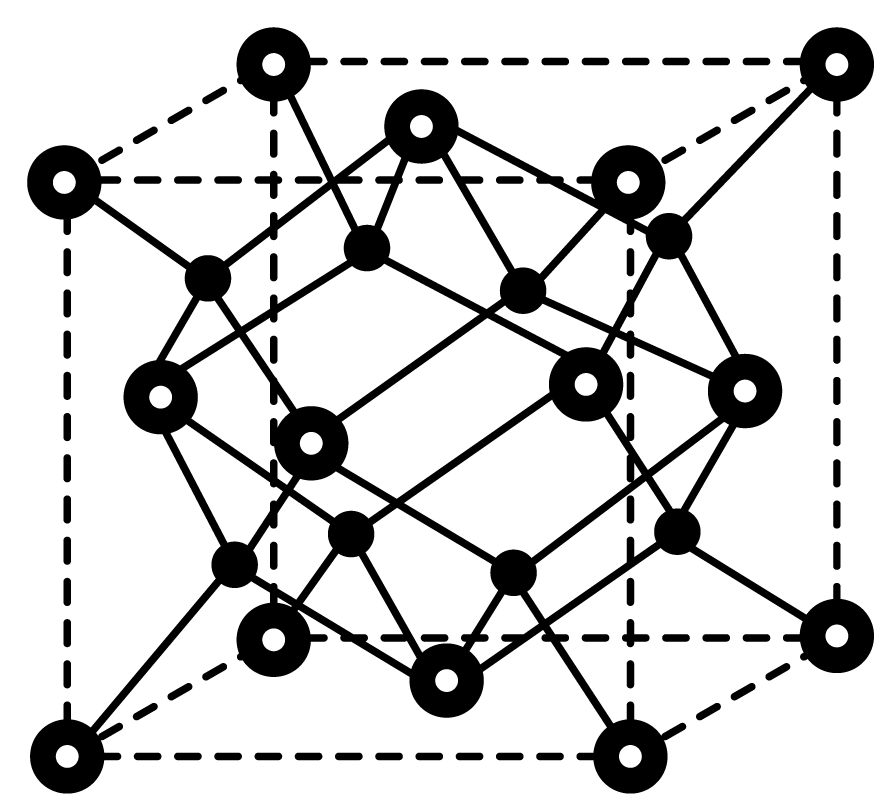
①在晶胞中的位置为;
②设阿伏加德罗常数的值为。晶胞
的密度为b
, 则晶胞参数(棱长)为pm。
已知:25℃时,的电离常数:
,
;
的电离常数:
,
;
的溶度积常数:
。
Ⅰ.性质探究
①甲同学认为发生了相互促进的水解反应,生成了胶体,用激光笔照射试管,预期的现象为。
②若上述水解过程存在反应: , 则25℃时该反应的化学平衡常数K=(代入数据列出计算式)。
③乙同学认为可能同时发生反应: , 并设计实验验证:取少量用蒸馏水稀释后的反应液于试管中,再滴加溶液,观察现象。
A.KSCN B. C.
D.
已知所得产物含有少量(无其他杂质),25℃时相同质量的
和
分别溶于等量的水后,体积基本相同。
①25℃时质量分数相同的两种溶液,溶液的pH
溶液。
A.大于 B.小于 C.等于 D.无法判断
②丙同学设计实验探究实验产品是否符合化工行业标准。
查阅资料 合格品的行业标准是质量分数高于93%。
提出假设 实验产品中质量分数高于93%。
实验方案 常温下完成下述实验:
步骤1:用100.0mL水溶解0.7g和9.3g
, 测得
;
步骤2:,测得;
数据分析:ab(填“>”、“<”或“=”)。
实验结论 假设成立。
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 氯气能使湿润的红色布条褪色 | 氯气具有漂白性 | Ⅰ对;Ⅱ对;有 |
B |
|
| Ⅰ对;Ⅱ对;有关系 |
C | 金属钠在空气中很容易变质 | 金属钠具有强还原性 | Ⅰ错;Ⅱ对;有关系 |
C |
|
| Ⅰ对,Ⅱ对,有去 |
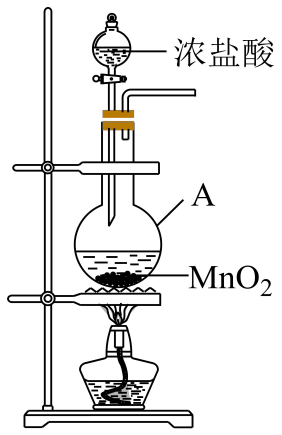
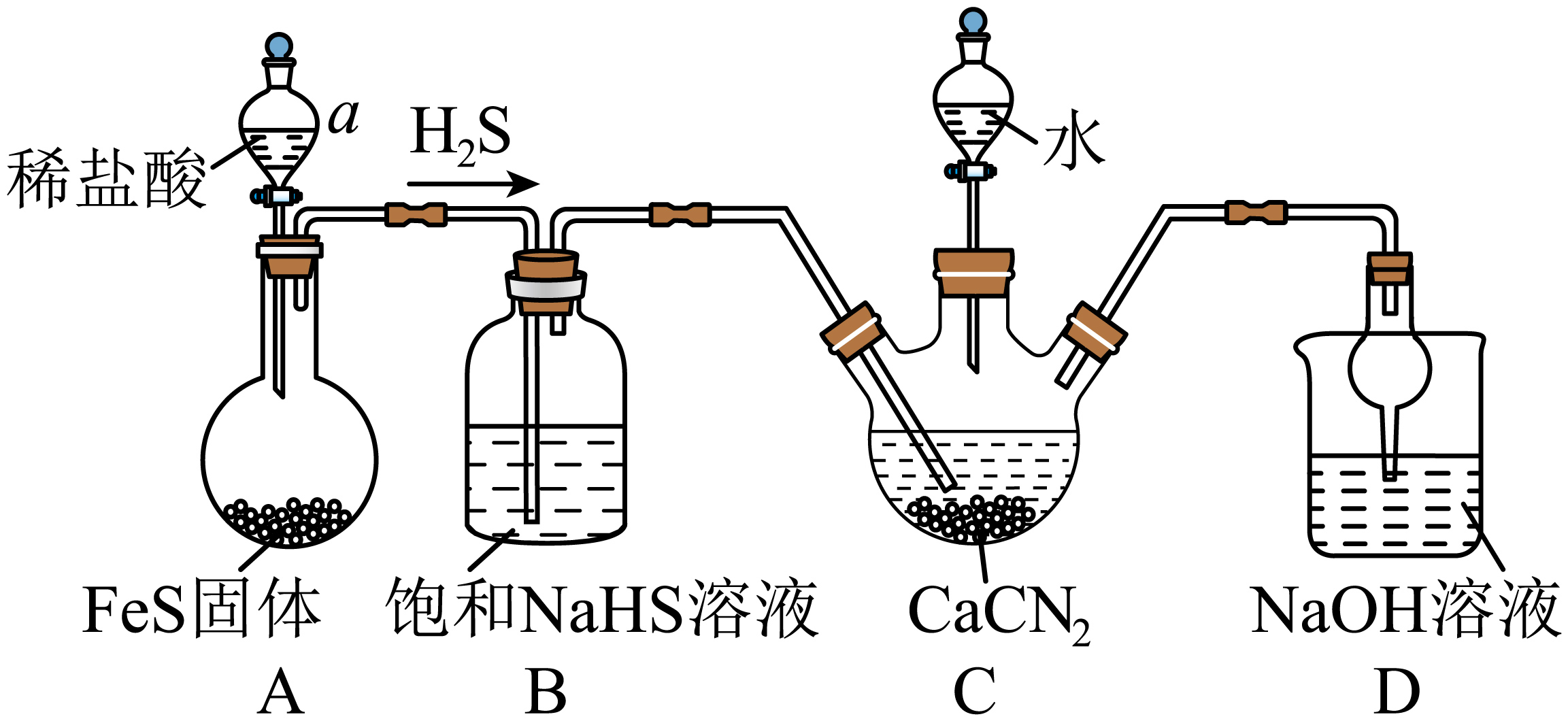
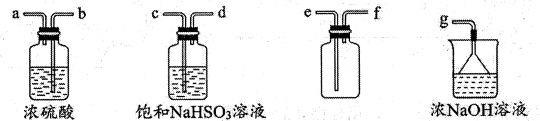
仪器A的名称为;A中反应的离子方程式为;
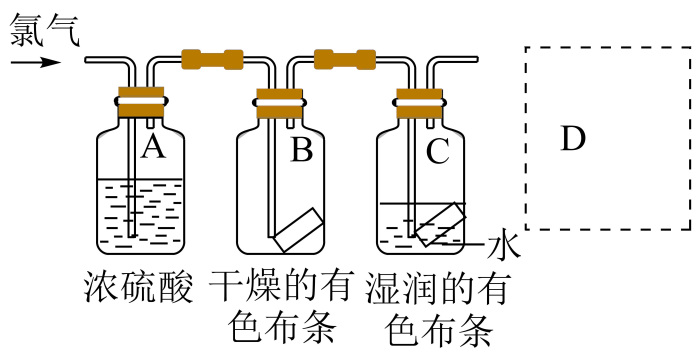
①浓的作用是;
②与研究目的直接相关的实验现象是,并解释产生上述现象的原因;
③该实验设计存在事故隐患,应在D处增加一装置,该装置的作用是。