
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。
I.
Ⅱ.
Ⅲ.。
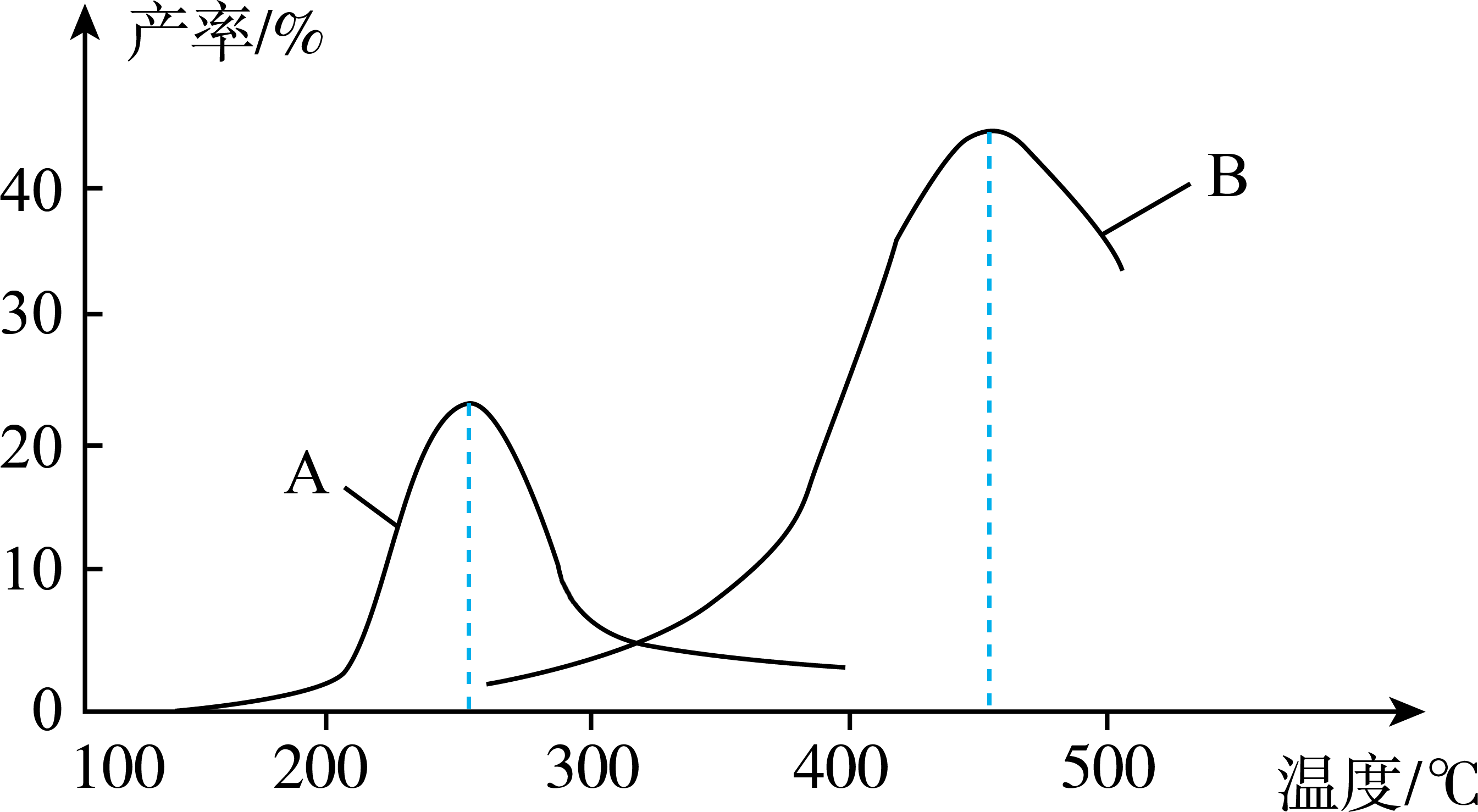
①下列说法正确的是(填序号)。
A.使用催化剂B的最佳温度约为250℃
B.相同条件下,改变压强会影响的产率
C.催化剂不仅能改变反应速率,还能改变平衡时![]() 产率
产率
D.两种催化剂均能降低反应的活化能,但不能改变的数值
②在催化剂A作用下,温度低于200℃时,的产率随温度升高变化不大,主要原因是。
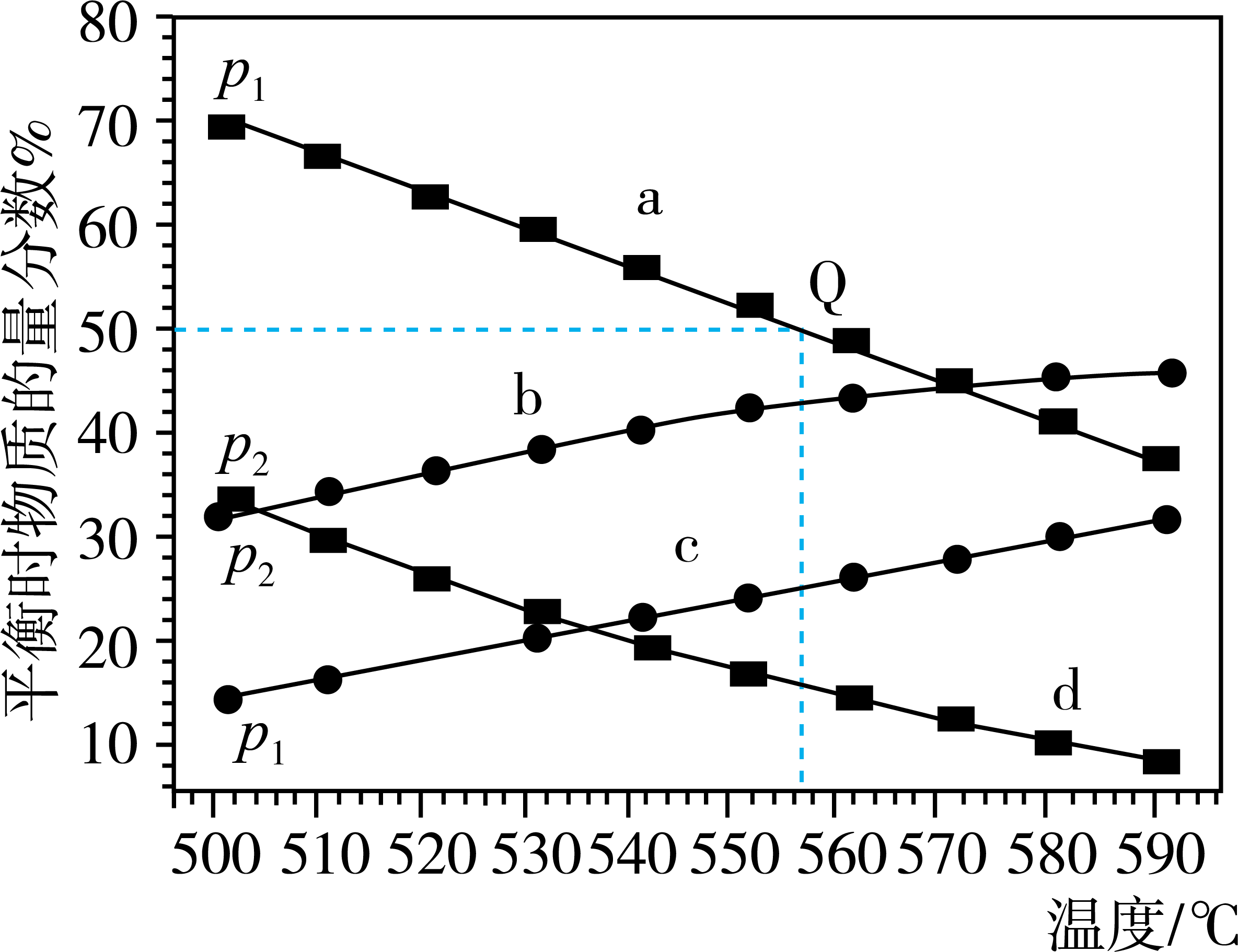
①b、c代表(填“丙烷”或“丙烯”),(填“大于”“小于”或“等于”)
②起始时充入一定量丙烷,在恒压条件下发生反应,Q点对应温度下丙烷的转化率为(用分数表示),该反应的平衡常数
=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
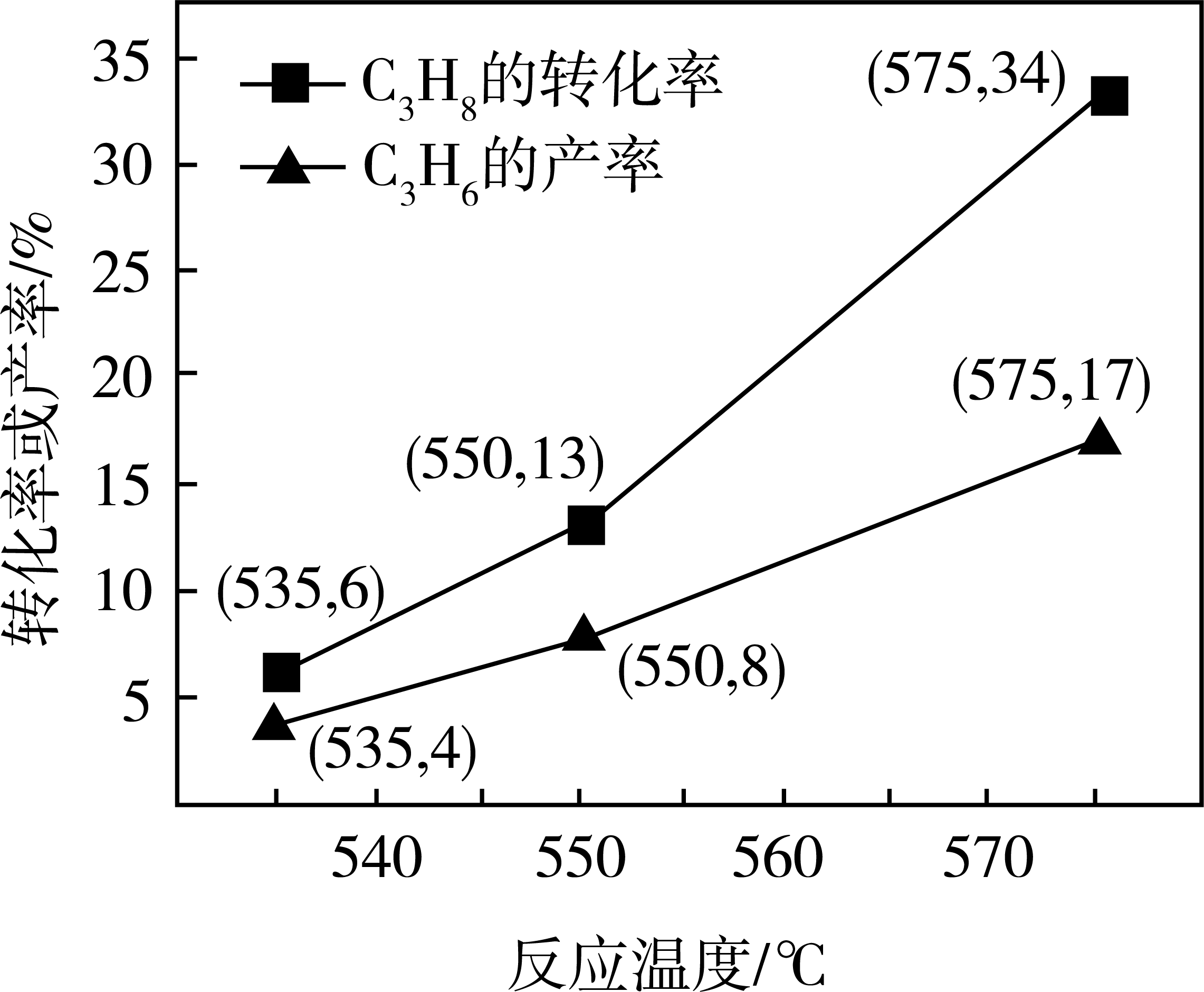
①550℃时,的选择性为%(
的选择性=
, 计算结果精确到0.1)。
②基于上述研究结果,能提高的选择性的措施是。

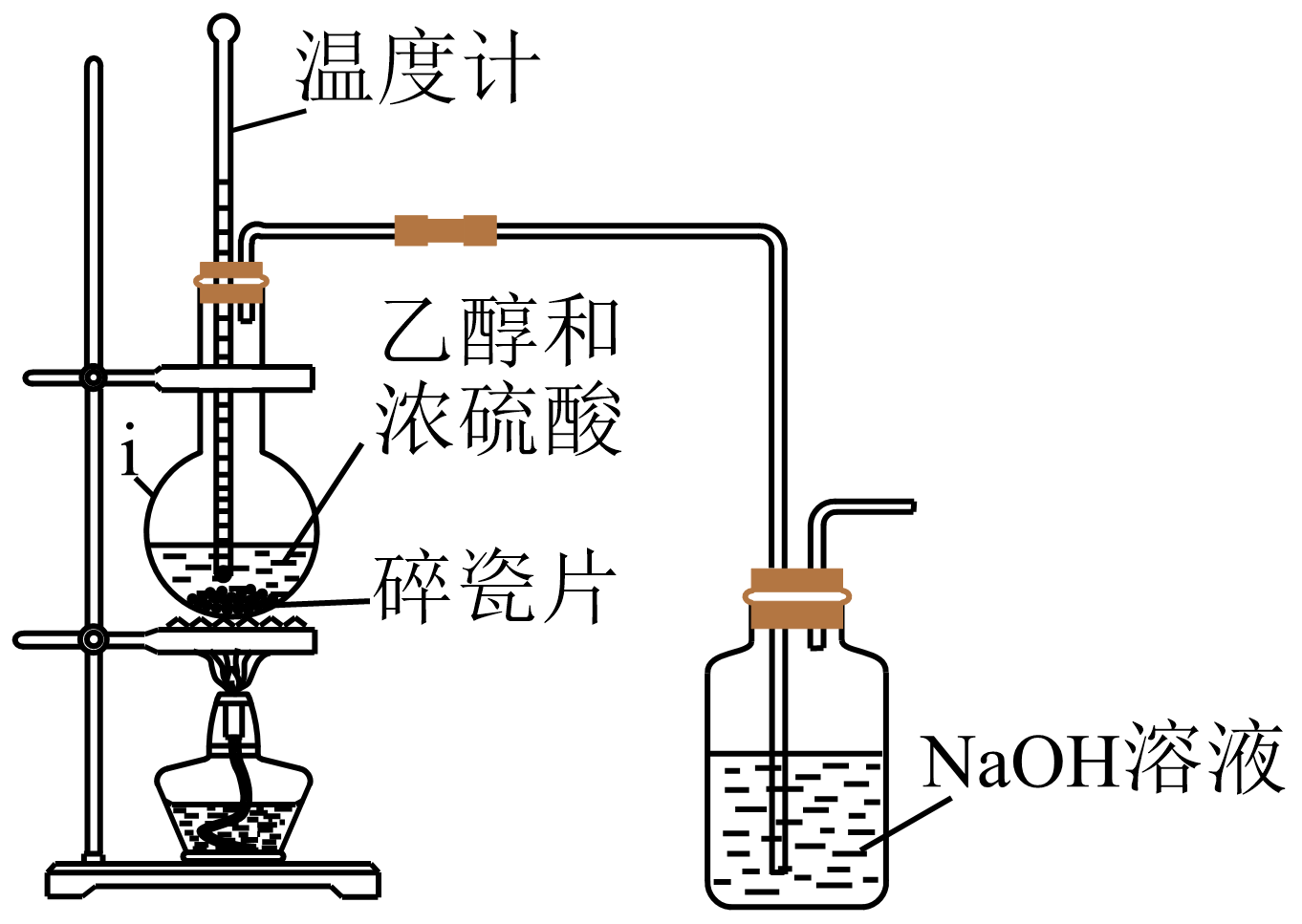
①所选装置的连接顺序为:A→→C→E(填“B”或“D”),不选另一装置的原因是:。
②实验开始时,点燃酒精喷灯适合在水浴加热之(填“前”或“后”)。
③已知制备时有
气体生成,制备
反应的化学方程式为;
气体易水解则尾气处理时适合选用的试剂为(填序号)。
A.溶液 B.稀
溶液 C.水
已知:
准确称取31.7g产品,温水溶解后稀释至250 , 量取25.00
溶液加入锥形瓶中,向其中加入足量
充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量
溶液;滴加淀粉作指示剂,用2
标准溶液滴定
, 达到滴定终点时消耗标准液的体积为15
。
①加入足量的主要作用为。
②写出加硫酸酸化后的橙色物质与溶液发生反应的离子方程式。
③反应后溶液煮沸的目的为。
④产品中的质量分数为。
| 实验目的 | 实验药品 |
A | 探究温度对化学平衡的影响 |
|
B | 验证乙醇的消去产物是乙烯 | 乙醇、酸性高锰酸钾溶液、浓硫酸 |
C | 证明牺牲阳极法保护铁 |
|
D | 比较水和四氯化碳分子的极性 |
|
已知:①常温下, ,
金属离子浓度等于时,可认为其恰好完全沉淀。
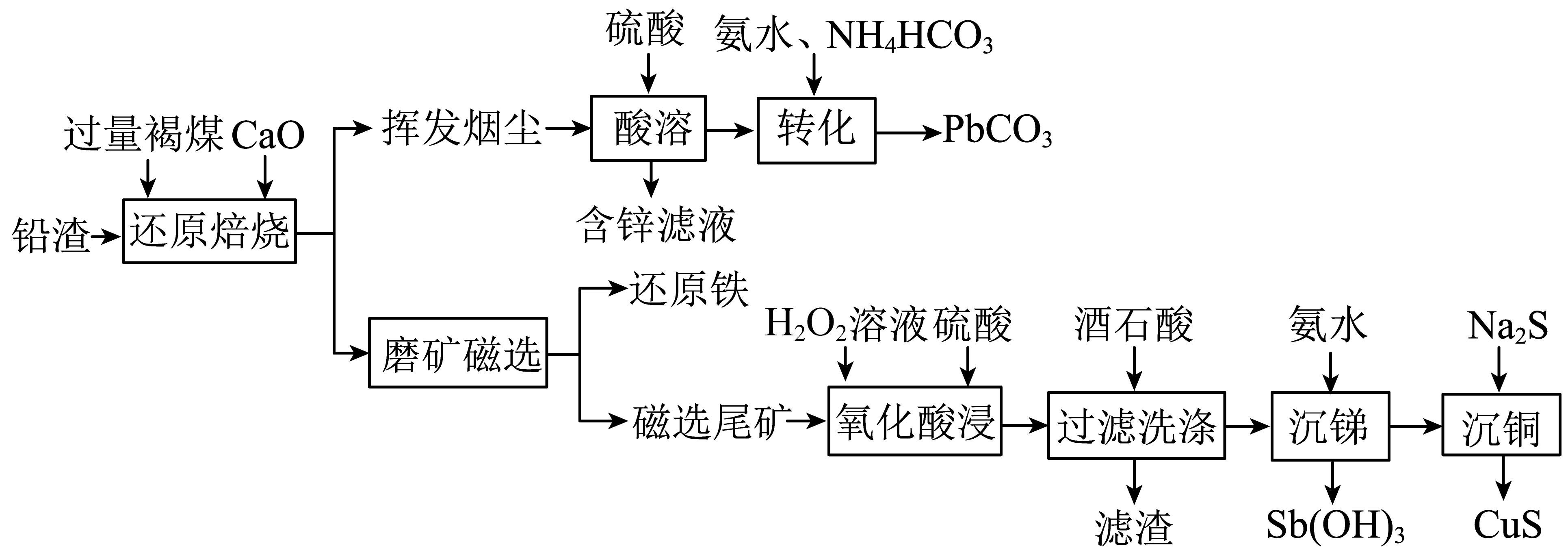
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为。
②“转化”过程中,发生反应的化学方程式为。
①上述两个配合物中,提供空轨道的元素为(填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为。
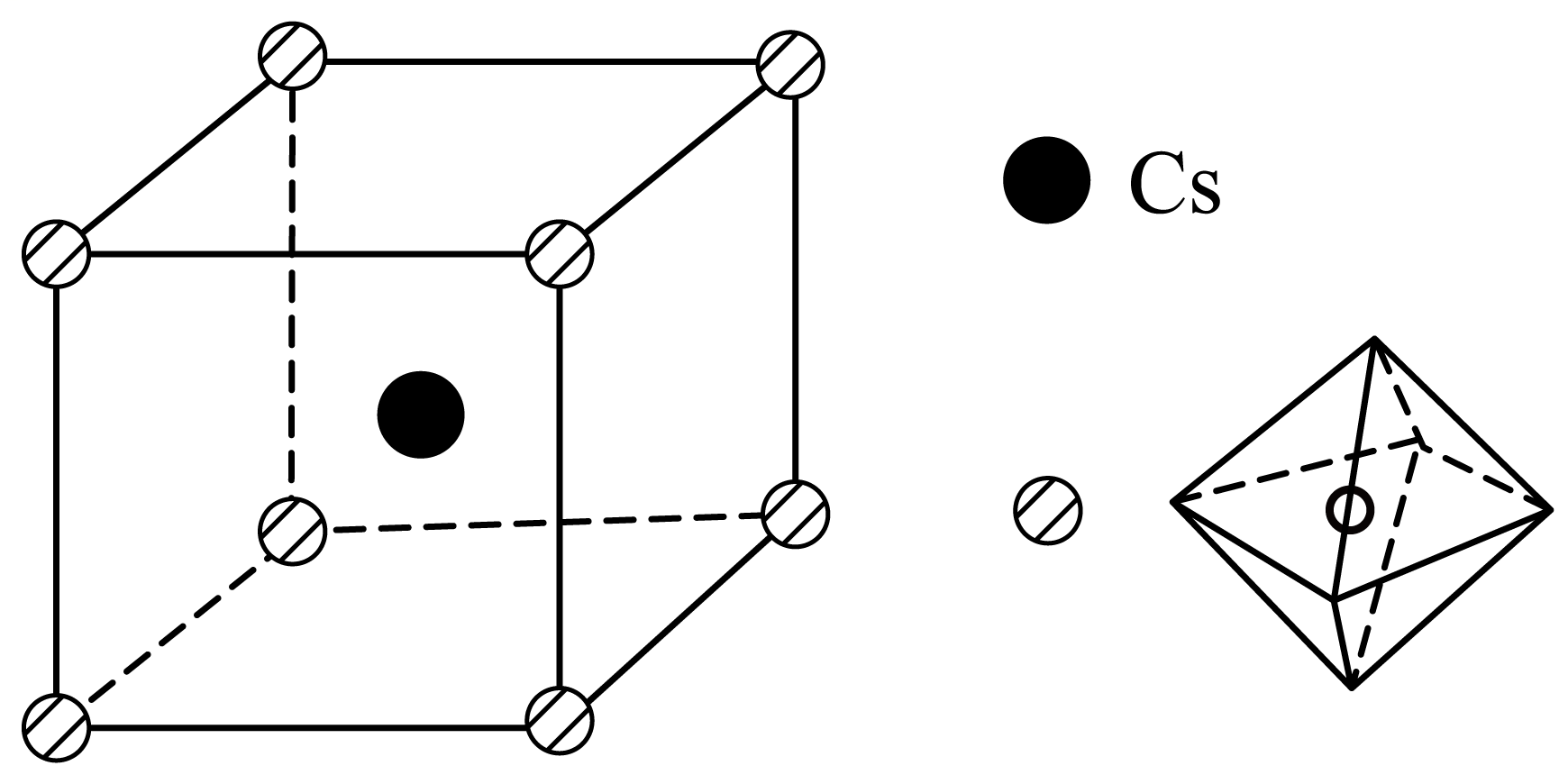
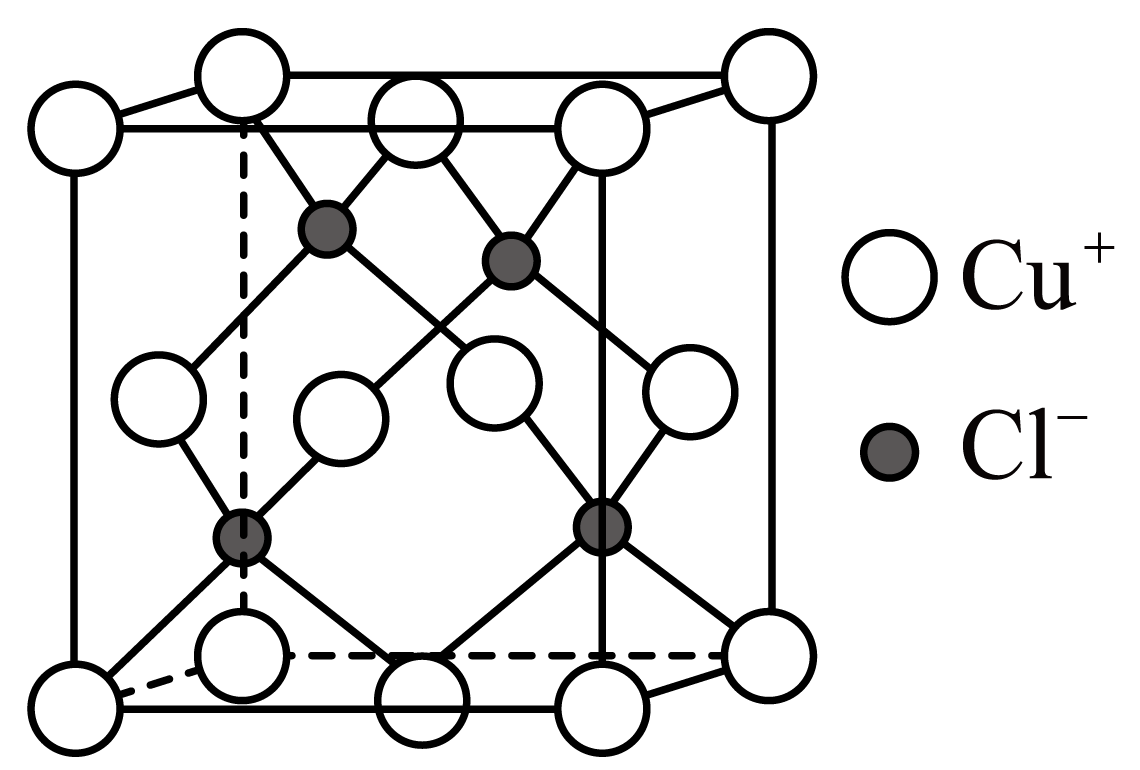
①该晶体的化学式为。
②若该晶体的晶胞以Cs为顶点,则Br在晶胞中的位置为。
I.制备乙烯
如图所示为制备纯净的乙烯的部分实验装置。
提出猜想1:发生加成反应只生成1,2-二溴乙烷。
验证猜想1
实验操作 | 预期实验现象 | 实际实验现象 |
向一定浓度的溴水中匀速通入足量纯净的乙烯气体,并用pH传感器检测溶液pH的变化。 | ( ),溶液的pH变大 | 溴水褪色,溶液没有明显的分层现象,溶液的pH变小 |
请补充预期实验现象:。预期实验现象中pH变大,请利用平衡移动的原理说明原因:。
提出猜想2:发生取代反应生成1-溴乙烯(实验条件下为不溶于水的无色气体)和HBr。
验证猜想2
实验装置 | 实验操作 | 实验现象 | 实验结论 |
| 1.向装置中加入足量的溴水,同时打开活塞a、b,下压钟罩排尽体系内空气后关闭活塞a; 2.通入适量的乙烯,排出钟罩内部分澳水后,关闭活塞b。静置一段时间 | ( ) | 猜想2不成立 |
说明:通入的乙烯不能过量,要确保溴水未完全褪色。
查阅资料
乙烯与Br2反应生成1,2-二溴乙烷的机理如下图所示:
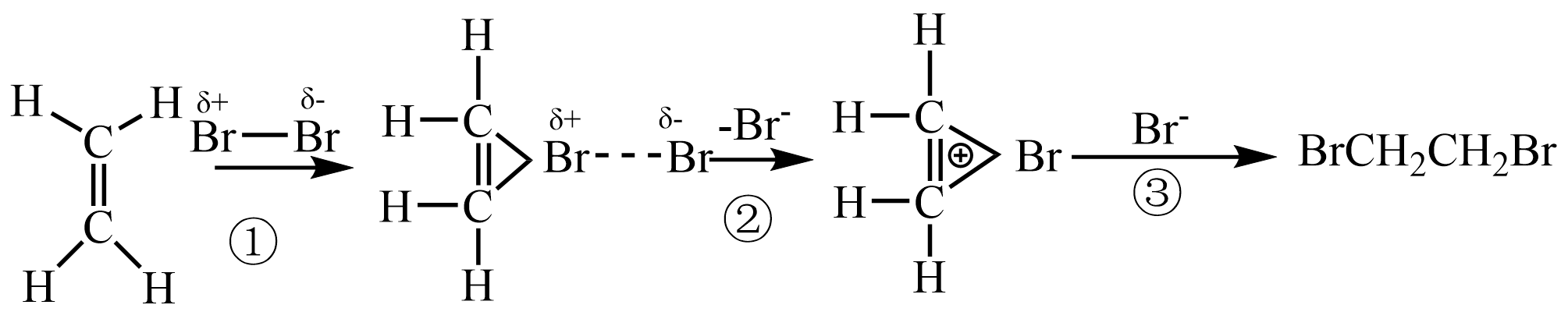
说明:“---”表示共价键未完全断裂或形成。
教师指导:乙烯与溴水反应时,第①步和第②步与上述机理相同,第③步主要是H2O参与了反应,导致溶液的pH变小。