①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4 , 同时产生NO。该反应的离子方程式为。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O ):c(HC2O
)=。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
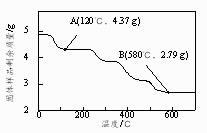
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)(写出计算过程)。