1.
(2024九上·余杭期末)
小科在学习“常见的碱”过程中,将新配制的饱和Ca(OH)2溶液滴入到FeCl3溶液中,发现没有出现预期的红褐色沉淀。这是为什么呢?
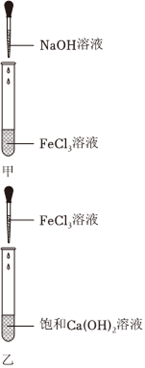
小科查阅资料,获取如下信息:
①Ca(OH)2微溶于水:②FeCl3溶液呈酸性。
于是他提出以下猜想:
猜想一:Ca(OH)2没有参加化学反应。
猜想二:滴入的Ca(OH)2溶液中OH-数量太少。
猜想三:FeCl3溶液呈酸性,Fe(OH)3沉淀不能存在。
-
(1)
小科用pH试纸测Ca(OH)2和FeCl3混合液的酸碱度,测得pH<7,说明溶液中没有OH。该现象(填“支持”或“不支持”)猜想一。
-
-
(2)
为增加OH的数量,换用浓NaOH洛液滴加到FeCl3溶液中(如图甲),若猜想二正确,则观察到的现象是。
-
-
(3)
经过实验,猜想三验证成立。然后,小科将FeCl3溶液逐滴滴加到饱和Ca(OH)2溶液中(如图乙),先观察到红褐色沉淀产生,持续滴加后沉淀又消失了。请你解释沉淀会消失的原因:。
-
