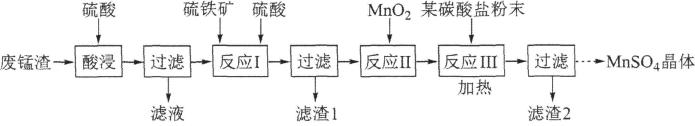
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
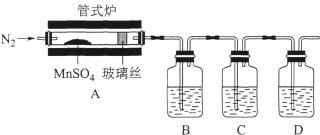
①装置B、C、D中的溶液依次为(填字母)。
a.Ba(NO3)2b.BaCl2c.品红 d.浓硫酸e.Ca(OH)2 f.NaOH
②实验结束时,为防止倒吸,正确的操作方法是。
①计算产品中MnSO4的质量分数(保留两位有效数字)。
②为提高测定的精度,应补充的实验操作。