
查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:i.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的
颜色有明显不同。

配制Cu(OH)2悬浊液时,要保证溶液过量。(填“NaOH”或“CuSO4”)

①根据上述实验可得结论:该红色固体为。
②产生红色固体的原因是(用离子方程式表示)。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝
色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验i的目的是。
②溶液显绿色的原因可能是溶液中含有较多Cu (HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入(填化学式),得到绿色溶液。
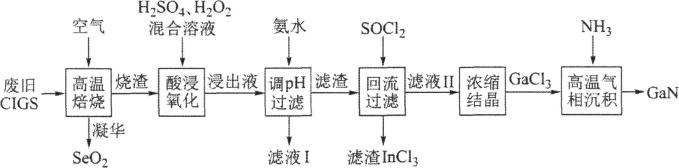
回答下列问题:
断,你认为不正确的是____。
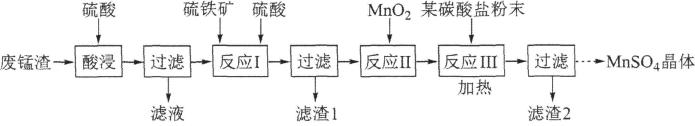
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
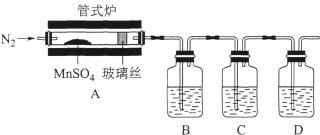
①装置B、C、D中的溶液依次为(填字母)。
a.Ba(NO3)2b.BaCl2c.品红 d.浓硫酸e.Ca(OH)2 f.NaOH
②实验结束时,为防止倒吸,正确的操作方法是。
①计算产品中MnSO4的质量分数(保留两位有效数字)。
②为提高测定的精度,应补充的实验操作。