
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是(写化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是。
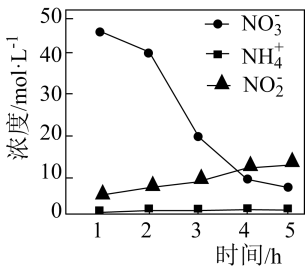
①Fe去除水中的NO 的机理:NO
得到纳米铁粉失去的电子转化为NO
, 极少量NO
在纳米铁粉或Cu表面得到电子转化为NH
。与不添加少量铜粉相比,添加少量铜粉时去除NO
效率更高,主要原因是。
②与初始溶液中NO浓度相比,反应后溶液中所有含氮物质(NO
、NO
、NH
)总浓度减小,原因是。
微信扫码预览、分享更方便