
①该反应是(填“吸热”或“放热”)反应,其原因是反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是(填序号)。
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
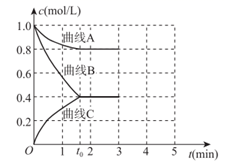
①表示c(N2)变化的曲线是(填“A”“B”或“C”)。
②0~t0时用H2表示的化学反应速率:v(H2)=mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是(填序号,可多选)。
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键